I.3.4 ВЗАИМНЫЕ ПРЕВРАЩЕНИЯ ЖИДКОСТЕЙ И ГАЗОВ
1. ИСПАРЕНИЕ ЖИДКОСТЕЙ
Парообразованием называется процесс перехода из жидкого состояния в газообразное. Парообразование, происходящее при любой температуре со свободной поверхности жидкости, называется испарением. Совокупность молекул, вылетевших из жидкости при парообразовании, называется паром данной жидкости. Образование пара происходит не только у жидкостей, но и у твёрдых тел.
Из поверхностного слоя жидкости вылетают молекулы, которые обладают наибольшей скоростью и кинетической энергией теплового, хаотического движения, поэтому в результате испарения жидкость охлаждается.
Мерой процесса парообразования является скорость парообразования – количество жидкости, переходящей в пар за единицу времени с единицы площади поверхности жидкости.
2. НАСЫЩЕННЫЙ ПАР
Наряду с процессом парообразования, происходит компенсирующий его обратный процесс конденсации – превращения пара в жидкость. Скорость конденсации определяется числом молекул, переходящих из пара в жидкость через единицу площади поверхности жидкости в единицу времени.
Если скорость парообразования становится равной скорости конденсации, то наступает состояние динамического равновесия между процессами парообразования и конденсации.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром. Давление насыщенного пара зависит только от его химического состава и температуры (быстро возрастает с ростом температуры) и не зависит от величины свободного от жидкости объёма сосуда, в котором находится пар.
3. КИПЕНИЕ
Кипением называется процесс интенсивного парообразования не только со свободной поверхности, но и по всему объёму жидкости внутрь образующихся при этом пузырьков пара.
Температурой (точкой) кипения называется температура жидкости, при которой давление её насыщенного пара равно или превышает внешнее давление. Температура кипения повышается с ростом внешнего давления и понижается при его уменьшении. Различие точек кипения разных жидкостей связано с тем, что у разных жидкостей неодинаково давление насыщенного пара при одной и той же температуре. Чем выше давление насыщенного пара, тем выше точка кипения.
Количество теплоты, необходимое для превращения в пар единицы массы жидкости, нагретой до температуры кипения, называется удельной теплотой парообразования. Из закона сохранения энергии следует, что при обратном процессе – конденсации пара в жидкость – выделяется количество теплоты, равное удельной теплоте парообразования.
Если кипение данной жидкости происходит при более высокой (или низкой) температуре, то удельная теплота парообразования уменьшается (или увеличивается). Это связано с зависимостью давления насыщенного пара от температуры и условия кипения.
4. ВЛАЖНОСТЬ ВОЗДУХА
Абсолютной влажностью воздуха f называется масса водяных паров, содержащихся в 1 м3 воздуха при данных условиях.
Относительной влажностью воздуха 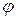 называется отношение абсолютной влажности к тому количеству водяного пара, которое необходимо для насыщения 1 м3 воздуха при данной температуре.
называется отношение абсолютной влажности к тому количеству водяного пара, которое необходимо для насыщения 1 м3 воздуха при данной температуре.
Относительную влажность можно определить как отношение давления водяного пара (р), содержащегося в воздухе, к давлению насыщенного пара (рн) при данной температуре
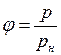 . (I.77)
. (I.77)
Обычно 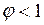 и её выражают в процентах.
и её выражают в процентах.
Точкой росы называется температура, при которой водяные пары, не насыщавшие ранее воздух, становятся насыщающими. Зная температуру воздуха и определив точку росы, рассчитывают влажность воздуха. При этом используется таблица давления насыщенного водяного пара при различных температурах.
§I.3.5СТРОЕНИЕ ЖИДКОСТЕЙ. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
Жидкое состояние, занимая промежуточное положение между газами и твердыми телами, сочетает в себе некоторые черты обоих этих состояний. Молекулы жидкости связаны силами Ван – дер – Ваальса, которые, с одной стороны, недостаточны для осуществления постоянной и прочной структуры, однако, с другой стороны, под их действием молекулы уже не могут сохранять той самостоятельности и подвижности, которые характерны для газа. Жидкое состояние представляет большие трудности для теоретического объяснения. До сих пор нет вполне законченной и общепризнанной теории жидкостей. Значительные заслуги в разработке ряда проблем теории жидкого состояния принадлежат советскому ученому Я.И. Френкелю. Тепловое движение в жидкости он объяснял тем, что каждая молекула в течение некоторого времени колеблется около определённого положения равновесия, после чего скачком переходит в новое положение, отстоящего от исходного на расстоянии порядка межатомного. Таким образом, молекулы жидкости медленно перемещаются по всей массе жидкости, и диффузия происходит медленнее, чем в газах. С повышением температуры жидкости частота колебательного движения резко увеличивается, возрастает подвижность молекул, что, в свою очередь, является причиной уменьшения вязкости жидкости.
Заметное воздействие молекул друг на друга наблюдается в пределах радиуса молекулярного действия (r), равного нескольким эффективным диаметрам молекулы. Сфера радиуса (r) называется сферой молекулярного действия.
Результирующие силы всех молекул поверхностного слоя оказывают на жидкость давление, называемое молекулярным (или внутренним). Молекулярное давление не действует на тело, помещенное в жидкость, так как оно обусловлено силами, действующими только между молекулами самой жидкости. Частицы поверхностного слоя жидкости имеют большую потенциальную энергию, чем частицы, которые находятся внутри жидкости. Это связано с тем, что для изотермического перехода молекул изнутри жидкости на её поверхность они должны совершить работу по преодолению направленных внутрь жидкости сил внутреннего давления. Эта работа увеличивает потенциальную энергию молекул, переходящих на поверхность.
Дополнительная энергия, которой обладают молекулы в поверхностном слое жидкости, называется поверхностной энергией. Наличие поверхностной энергии обусловливает стремление жидкости к сокращению своей поверхности. Жидкость ведёт себя так, как если бы она была заключена в упругую растянутую плёнку, стремящуюся сжаться. На самом деле никакой плёнки, ограничивающей жидкость снаружи, нет. Поверхностный слой состоит из тех же молекул, что и вся жидкость, и взаимодействие между молекулами имеет в поверхностном слое такой же характер, как и внутри жидкости.
Поверхностная энергия может быть рассчитана по формуле
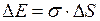 , (I.78)
, (I.78)
где 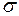 – коэффициент поверхностного натяжения;
– коэффициент поверхностного натяжения;
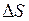 – приращение площади поверхностного слоя плёнки.
– приращение площади поверхностного слоя плёнки.
Коэффициентом поверхностного натяжения жидкости называется работа, необходимая для изотермического увеличения площади поверхности жидкости на одну единицу
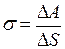 . (I.79)
. (I.79)
Кроме того, этот коэффициент можно вычислить также по формуле
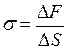 , (I.80)
, (I.80)
где 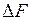 – изменение свободной энергии поверхностного слоя.
– изменение свободной энергии поверхностного слоя.
Коэффициент поверхностного натяжения 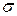 зависит от химического состава жидкости и её температуры. С увеличением температуры
зависит от химического состава жидкости и её температуры. С увеличением температуры 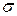 уменьшается и обращается в нуль при критической температуре. При введении в жидкости примесей поверхностно-активных веществ (например, таких как: мыло, жирных кислот и т.п.) коэффициент поверхностного натяжения уменьшается. Это связано с тем, что такие вещества абсорбируются в поверхностном слое жидкости и уменьшают свободную энергию слоя.
уменьшается и обращается в нуль при критической температуре. При введении в жидкости примесей поверхностно-активных веществ (например, таких как: мыло, жирных кислот и т.п.) коэффициент поверхностного натяжения уменьшается. Это связано с тем, что такие вещества абсорбируются в поверхностном слое жидкости и уменьшают свободную энергию слоя.
§I.3.6СМАЧИВАНИЕ. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ.
Поверхностные явления существуют не только на границе пара и жидкости, но и на границе с твердым телом. Когда жидкость соприкасается с твердым телом, силы поверхностного натяжения могут вызвать либо растекание жидкости по твердому телу (смачивание), либо, наоборот, уменьшение поверхности соприкосновения (несмачивание). Если жидкость находится в капилляре (узкие цилиндрические трубки с диаметром около миллиметра и менее), то явление смачивания или несмачивания приводит к искривлению поверхностного слоя жидкости. Искривлённые поверхности жидкости в капиллярах называются менисками. Если жидкость смачивает стенки капилляра, мениск имеет вогнутую форму, если не смачивает – выпуклую форму. Искривлённая поверхность оказывает на жидкость избыточное (добавочное) давление. Это давление, обусловлено силами поверхностного натяжения. Поверхностные силы дают результирующую, действующую внутрь несмачивающей жидкости или наружу в случае смачивающих жидкостей (лапласовские силы); в первом случае уровень жидкости в капилляре понизится, во втором – повысится (по отношению к уровню жидкости, находящейся в широком сосуде).
Избыточное давление для произвольной поверхности жидкости двоякой кривизны, можно определить по формуле Лапласа
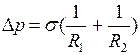 , (I.81)
, (I.81)
где 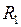 и
и 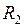 – радиусы кривизны двух любых взаимно перпендикулярных нормальных сечений поверхности жидкости в данной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
– радиусы кривизны двух любых взаимно перпендикулярных нормальных сечений поверхности жидкости в данной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
Для сферически искривлённой поверхности 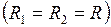 выражение (I.81) примет вид
выражение (I.81) примет вид
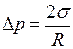 . (I.82)
. (I.82)
Для цилиндрически искривлённой поверхности 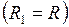 и
и 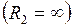 – избыточное давление
– избыточное давление
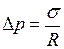 . (I.83)
. (I.83)
Для плоской поверхности 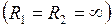 силы поверхностного натяжения избыточного давления не создают.
силы поверхностного натяжения избыточного давления не создают.
Уровень идеально смачивающей (несмачивающей) жидкости в капилляре радиуса r выше (ниже), чем в сообщающемся с ним широком сосуде, на высоту h, равную
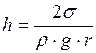 , (I.84)
, (I.84)
где 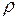 – плотность жидкости;
– плотность жидкости; 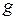 – ускорение силы тяжести.
– ускорение силы тяжести.
Формула (I.84) носит название формулы Жюрена (она связывает высоту подъема или опускания жидкости в капилляре с радиусом капилляра, плотностью жидкости и коэффициентом ее поверхностного натяжения).
В трубках значительного внутреннего диаметра искривленная поверхность жидкости уже не имеет сферической формы, поэтому формула Жюрена к ним не применима. При очень большом диаметре искривленные участки поверхности очень малы (по отношению ко всей поверхности) и не могут оказать влияния на уровень жидкости в трубке.
Изменения высоты уровня в капиллярах называются капиллярными явлениями. Они связаны с тем, что для равновесия смачивающей жидкости в капилляре избыточное давление должно быть равно гидростатическому давлению ( 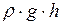 ). Снижение уровня несмачивающей жидкости в капилляре объясняется тем, что дополнительное давление вытесняет жидкость из капилляра до тех пор, пока не установится равновесие такое же, как для смачивающей жидкости (
). Снижение уровня несмачивающей жидкости в капилляре объясняется тем, что дополнительное давление вытесняет жидкость из капилляра до тех пор, пока не установится равновесие такое же, как для смачивающей жидкости ( 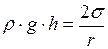 ).
).
Капиллярными явлениями объясняется свойство ряда тел (вата, ткани, почвы, бетон и т.д.) впитывать влагу (гигроскопичность тел).
§I.3.7СТРОЕНИЕ И НЕКОТОРЫЕ СВОЙСТВА ТВЁРДЫХ ТЕЛ
Твёрдыми телами называются тела, которые обладают постоянством формы и объёма. Различают кристаллические и аморфныетвёрдые тела.
Аморфные твёрдые тела (вар, стекло и др.) представляют собой переохлаждённые жидкости и не обладают чётко выраженными свойствами кристаллов.
Кристаллы имеют вид многогранника, иногда правильной геометрической формы и периодически повторяющееся на протяжении всего кристалла расположение составляющих его частиц – кристаллическую решётку. Кристаллы ограничены упорядоченно расположенными друг относительно друга плоскими гранями, которые сходятся в рёбрах и вершинах. Крупные одиночные кристаллы, имеющие форму многогранников, называются монокристаллами. Их форма определяется химическим составом кристалла. Характерной особенностью монокристаллов является их анизотропия (анизотропия кристаллов) - зависимость ряда физических свойств (механических, тепловых, электрических, оптических) от направлений в кристалле. Тела, свойства которых одинаковы по всем направлениям, называются изотропными.
Поликристаллы имеют мелкокристаллическую структуру – состоят из большого числа сросшихся мелких, хаотически расположенных кристаллов (кристаллические зёрна, кристаллиты). В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинакова.
Каждая частица в кристаллической решётке испытывает силы межмолекулярного взаимодействия. Равновесное расположение всех частиц твёрдого тела в узлах кристаллической решётки (точки, в которых расположены частицы, а точнее - точки, относительно которых частицы совершают колебания) соответствует минимуму свободной энергии кристалла и наиболее устойчивому его состоянию. При этом частицы в узлах решётки располагаются на некоторых равновесных расстояниях друг от друга, называемых периодом кристаллической решётки.
Существует два признака для классификации кристаллов: кристаллографический и физический.
Кристаллографический признак кристаллов. В этом случае важна только пространственная периодичность в расположении частиц.
Кристаллическая решётка может обладать различными видами симметрии. Симметрия кристаллической решётки – её свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т.д.
С переносной симметрией в трёхмерном пространстве связывают понятие трёхмерной периодической структуры – пространственной решётки, или решётки Бравэ. Всякая пространственная решётка может быть составлена повторением в трёх различных направлениях одного и того же структурного элемента – элементарной ячейки. Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно рёбрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки.
Физический признак кристаллов. В зависимости от вида частиц, помещающихся в узлах кристаллической решётки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решёток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
Ионные кристаллы. В узлах кристаллической решётки помещаются ионы разных знаков. Силы взаимодействия между ними являются электростатическими (кулоновскими). Связь, обусловленная электростатическими силами притяжения между разноимённо заряженными ионами, называется гетерополярной или ионной. Типичными примерами ионных кристаллов являются: углекислый кальций, каменная соль (NaCl) и др. соли.
Атомные кристаллы. В узлах кристаллической решётки помещаются нейтральные атомы. Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, называется гомеополярной или ковалентной. Силы взаимодействия при такой связи имеют также электрический (но не кулоновский) характер. Объяснение этих сил может быть дано только на основе квантовой механики. Примером атомных кристаллов может служить алмаз.
Такую же решётку, как у алмаза, имеют типичные полупроводники – германий и кремний. Для этой решётки характерно то, что каждый атом окружён четырьмя равноотстоящими от него соседями, расположенными в вершинах правильного тетраэдра. Каждый из четырёх валентных электронов входит в электронную пару, связывающую данный атом с одним из соседей.
Металлические кристаллы. (Na, Cu, Al и др.). В узлах кристаллической решётки находятся положительные ионы, образовавшиеся после отщепления от атомов внешних (валентных) электронов, образующих электронный газ коллективизированных свободных частиц.
Особая металлическая связь является специфическим видом химической связи и возникает между ионами кристаллической решётки и электронным газом. Электроны «стягивают» положительные ионы (в основном электростатическими силами) и уравновешивают отталкивание между ионами. При расстояниях между ионами, равных периоду кристаллической решётки, образуется устойчивое состояние металлического кристалла.
Молекулярные кристаллы. В узлах кристаллической решётки помещаются определённым образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности, в связи с чем, их называют ван-дер-ваальсовскими силами. Молекулярные решётки образуют, например, вода (H2O), углекислота (CO2), азот (N2), кислород (О2) и водород (Н2). Таким образом, обычный лёд, а также сухой лёд (твёрдая углекислота) представляют собой молекулярные кристаллы.
§I.3.8ДЕФЕКТЫ В КРИСТАЛЛАХ
В предыдущем параграфе речь в основном шла об идеальных кристаллических структурах, но они существуют лишь в очень малых объёмах реальных кристаллов, в которых всегда имеются отклонения от упорядоченного расположения частиц в узлах решётки, называемые дефектами кристаллической решётки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристаллов (трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности.
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трёх типов: вакансия (отсутствие атома в узле кристаллической решётки); междоузельный атом (атом, внедрившийся в междоузельное пространство); примесный атом - атом примеси, или замещающий атом основного вещества в кристаллической решётке (примесь замещения), или внедрившийся в междоузельное пространство (примесь внедрения, только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, - в этом состоит их характерная особенность.
Дислокация представляет собой более сложный дефект структуры, чем любой из точечных дефектов. Искажение кристаллической структуры вызвано тем, что в часть объёма кристалла введена лишняя атомная плоскость. Искажение сосредоточено в основном вблизи нижнего края «полуплоскости» лишних атомов. Поэтому под дислокацией и понимается линия искажения, которая проходит вдоль края лишней атомной плоскости. Дислокация представляет собой «линейный» дефект. Линейные дефекты нарушают дальний порядок.
Важнейшая характерная особенность всех дислокаций состоит в том, что сильные искажения сосредоточены в непосредственной близости от дислокационной линии. Эта область называется ядром дислокации. В стороне от ядра деформации настолько малы, что к ним можно применять теорию малых деформаций, т.е. теорию упругости. Поэтому область вдали от ядра дислокации называется упругой областью.
Возможны два предельных вида дислокаций - краевая и винтовая. Любая конкретная дислокация обычно представляет собой сочетание этих двух видов. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию. Важнейшие особенности нарушения порядка в расположении атомов вокруг краевой дислокации – искажения возле края лишней полуплоскости. Они вызваны тем, что ближайшие атомы как бы пытаются согласовать своё расположение с резким обрывом лишней плоскости. Поэтому атомы, расположенные непосредственно над краем лишней полуплоскости, испытывают действие сжимающих напряжений: два атомных ряда, слева и справа от лишней плоскости прижаты друг к другу. Однако непосредственно под лишней полуплоскостью расстояние между аналогичными двумя атомными рядами больше, чем в искаженных участках кристалла. Соответственно в этом месте структура растянута. Это локальное расширение называется дилатацией. Кроме простого растяжения и сжатия решётки, в непосредственной близости от дислокации структура испытывает также сдвиговые напряжения. Однако искажения, вызванные сдвигом, гораздо сложнее, чем дилатация.
В случае винтовой дислокации ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности (она начинается у одного края кристалла и кончается у другого). Направление винта может быть как право-, так и левосторонним, а шаг винта может составлять от одного до нескольких межатомных расстояний на один полный оборот винта. У описанной выше простой дислокации шаг равен одному межатомному расстоянию на один полный оборот.
Как и в случае краевой дислокации, степень искажений зависит от расстояния до центра дислокации. Области, достаточно удалённые от винтовой дислокации, испытывают очень малые локальные искажения. Напротив, области вблизи центра сильно искажены, и здесь возникают локальные нарушения симметрии кристалла.
В противоположность искажениям вокруг краевой дислокации вблизи центра винтовой дислокации возникают не дилатации, а скручивание или сдвиг решётки. Атомы, находящиеся на винтовой поверхности, смещены со своих исходных мест в совершенном кристалле.
Плотность дислокаций - число дислокаций, приходящихся на единицу площади поверхности кристалла. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций.
Дата добавления: 2016-09-06; просмотров: 7999;











