Молекулярность и порядок реакции
Понятие молекулярность применяется только к одностадийным простым реакциям.
Молекулярность – это количество частиц, одновременным соударением которых осуществляется акт химического превращения. Молекулярность выражается целым числом- 1, 2, 3 ≠ 0
Для простых одномолекулярных реакций степень концентрации совпадет со стехиометрическим коэффициентом.
По числу участвующих в реакции молекул (или в элементарном акте) все реакции делятся на:
1) Мономолекулярные
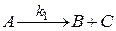
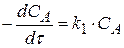 (1.14)
(1.14)
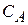 - текущая концентрация
- текущая концентрация
2) Бимолекулярные
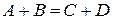
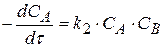 (1.15)
(1.15)
Если 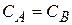 , то
, то 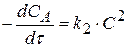
3) Тримолекулярные
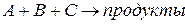
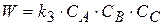 (1.16)
(1.16)
или 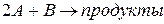
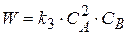 (1.17)
(1.17)
или 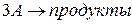
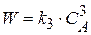 (1.18)
(1.18)
Как показывает опыт, трёхмолекулярные и четырехмолекулярные реакции встречаются редко.
Порядок реакции. Различают порядок реакции в целом и порядок реакции по компонентам (ПР)
ПР по компоненту - это степень, в которой концентрация реагирующего вещества входит в кинетическое уравнение скорости химической реакции
Скорость химической реакции зависит от концентрации реактантов.
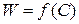
Рассмотрим тримолекулярную реакцию
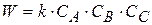 - реакция III порядка
- реакция III порядка
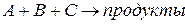
Пусть СА >> СВ и СС , тогда изменение концентрации А можно пренебречь
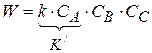 ,
,
тогда можно записать кинетическое уравнение следующим образом
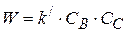 - реакция 2 порядка
- реакция 2 порядка
Суммарный порядок реакции находиться сложением порядков реакции по компонентам
Пусть СА и СВ >> СС, тогда 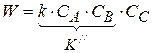
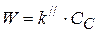 - это тримолекулярная реакция протекает согласно реакции I порядка.
- это тримолекулярная реакция протекает согласно реакции I порядка.
Порядок реакции находиться только экспериментальным путем и зависит от условий проведения процесса.
Сложные реакции протекают так, что одно из стадий может протекать медленнее других. Эта стадия называется лимитирующей. Она определяет скорость всего процесса.
Для сложных многостадийных реакций
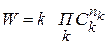 ,
,  (1.19)
(1.19)
где nk – порядок реакции по К – компоненту
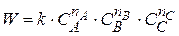 (1.20)
(1.20)
Дата добавления: 2017-03-12; просмотров: 2280;











