Классификация химических реакций
Основные понятия химической кинетики
Химическая кинетика – это наука, изучающая протекание химической реакции или физико – химических процессов во времени, это раздел физической химии, в котором изучается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды, излучения и других факторов.
Химическая кинетика позволяет рассчитать время заданной степени превращения вещества и найти наиболее эффективные факторы воздействия на скорость химической реакции.
Классификация химических реакций
С точки зрения кинетики существует несколько принципов классификации химических реакций:
1) по агрегатному состоянию участников реакции все реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции, когда все реактанты находятся в одной фазе. Они бывают:
а) газофазные
б) жидкофазные
в) твердофазные
Гетерогенные реакции, когда участники реакции находятся в разных фазах; реакция протекает на границе раздела фаз
2) по специфике элементарного акта
а) каталитические
б) некаталитические
в) фотохимические
г) электрохимические
д) цепные
3) по числу стадий
а) простые (1 стадия)
б) сложные
4) по обратимости реакций
а) обратимые (двусторонние)
б) необратимые
Реакция считается необратимой, если:
а) в результате реакции образуется газ
HCOOH → H2O + CO2 ↑
б) образуется труднорастворимое соединение
AgNO3 + KJ → AgJ↓ + KNO3
в) образуется малодиссоциируемое соединение
HNO3 + NaOH → NaNO3 + H2O
г) выделяется большое количество тепла
3Fe3O4 + 8Al → 4Al2O3 + 9Fe + ∆H↑
1.2. Элементарные химические реакции
Скорость химических реакций зависит от пути прохождения реакции. Этот путь может быть представлен в виде суммы элементарных химических реакций.
Элементарная реакция – это односторонний процесс превращения одних компонентов в другие. Она является совокупностью однотипных элементарных актов химического превращения. Большинство химических реакций не являются элементарными; они включают в себя несколько элементарных стадий – сложные реакции.
Механизм реакции – это совокупность элементарных стадий.
Реактант – участник химической реакции.
dρnk – бесконечно малое изменение числа молей компонента k в элементарной реакции ρ
Если dρnk > 0 – продукт реакции
dρnk < 0 – исходное вещество
dρnk = 0 – индифферентное вещество
1.3. Скорость химической реакции
Скорость химической реакции – это число однотипных элементарных актов химического превращения, совершающихся в единицу времени в единице объема или на единице поверхности.
Рассмотрим реакцию: 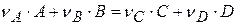
t = 0 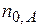
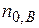
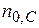
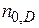 - исходные числа молей
- исходные числа молей
t ≠ 0 nA nB nC nD - текущие числа молей
(кси) ξ – глубина протекания реакций
ξ 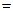
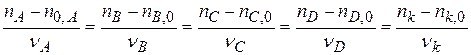
ξ 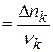 (1.1)
(1.1)
dξ 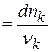 (1.2)
(1.2)
Под скоростью химической реакции понимается производная по времени от глубины протекания реакции.
Wp 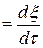 (1.3)
(1.3)
Wp 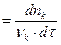 (1.4)
(1.4)
x – плотность глубины реакции, x = 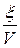
V – объем реакционной системы
x = 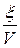 =
= 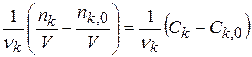 (1.5)
(1.5)
Wp(V) = 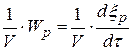 - плотность скорости реакции
- плотность скорости реакции
тогда Wp(V) = 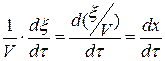 (1.6)
(1.6)
или Wp(V) = 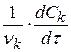 (1.7)
(1.7)
Скорость химической реакции можно определить по изменению концентрации одного из компонентов реакции
W(V) = 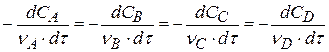 (1.8)
(1.8)
По мере протекания реакции ее скорость будет уменьшаться
Основной постулат Бекетова – Гульдберга – Вааги:
Скорость химической реакции пропорциональна концентрации исходных веществ в степенях, равных их стехиометрическим коэффициентам
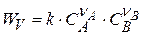 (1.9)
(1.9)
где k – константа скорости реакции
если 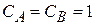 , то количественно
, то количественно 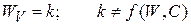
k определяется природой реакции, T и присутствием катализаторов; K называют удельной скоростью. Этот постулат справедлив для простых одностадийных реакций.
Дата добавления: 2017-03-12; просмотров: 2096;











