Первый закон термодинамики
Первый закон термодинамики: теплота может превращаться в механическую работу, а работа в теплоту лишь в строго эквивалентных количествах, причем количество теплоты, полученное рабочим телом от какого-либо источника тепла, равно сумме приращения внутренней энергии этого тела и количества совершенной им работы, т. е.
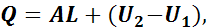 (1.4)
(1.4)
где Q — подведенная к рабочему телу теплота;
А — коэффициент пропорциональности;
L — работа, произведенная рабочим телом в результате подвода теплоты;
U1 — внутренняя энергия рабочего тела в начале подвода теплоты;
U2 — внутренняя энергия рабочего тела в конце подвода теплоты.
В 1843—1860 гг. английский физик Джоуль провел опыт по установлению соотношения между работой, затраченной при выделении теплоты и количеством выделенной теплоты. Ему удалось вычислить величину
A = 0,002345 ккал (кгс • м), которая называется тепловым эквивалентом работы. Также он вычислил и механический эквивалент теплоты I:
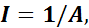
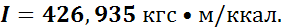
В настоящее время для измерения количества теплоты и работы используются различные единицы, соотношения между которыми приведены в табл. 1.
В дальнейшем для упрощения в термодинамических уравнениях коэффициенты А и I будут опускаться, а работа и теплота будут выражаться в одинаковых единицах.
Таблица 1. Соотношения между единицами измерения теплоты и работы
| Единица | Дж | энг | кгс•м | ккал | кВт•ч |
| Дж | - | 107 | 0,101972 | 2,4•10-4 | 2,7778•10-7 |
| эрг | 10-7 | - | 10,1972•10-9 | 24•10-12 | 27,778•10-15 |
| кгс•м | 9,80665 | 98,0665•106 | - | 2,3•10-3 | 2,7207•10-6 |
| ккал | 4186,8 | 41,868•109 | 426,935 | - | 1,163•10-3 |
| кВт•ч | 3,6•106 | 36•1012 | 367 098 | 859,862 | - |
Для рабочего тела массой 1 кг уравнение первого закона термодинамики примет вид:
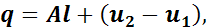
где q — удельная теплота, подводимая к рабочему телу или отводимая от него;
l — удельная работа изменения объема рабочего тела;
u1 и u2 — удельная внутренняя энергия в начале и конце подвода теплоты соответственно.
В термодинамике принято следующее:
• теплоту Q считать положительной, если она подводится к газу и отрицательной, если она отводится;
• изменение внутренней энергии ∆U считать положительным, если температура газа растет, и отрицательным, если она падает;
• работу L считать положительной, если газ расширяется и отрицательной, если газ сжимается под действием внешних сил.
Внутренняя энергия
Внутренняя энергия состоит из внутренней кинетической и внутренней потенциальной энергий. Первая — результат хаотического движения частиц тела, с увеличением скорости которых возрастает и внутренняя кинетическая энергия.
Так как температура тела определяется скоростью движения его частиц (молекул), то увеличение температуры тела означает увеличение его внутренней кинетической энергии.
Внутренняя потенциальная энергия связана с силами взаимодействия между частицами вещества.
Изменение удельной внутренней энергии в процессе подвода или отвода теплоты может быть выражено уравнением
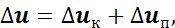
где ∆uк — изменение кинетической энергии газа,
∆uп — изменение потенциальной энергии газа.
Так как силы взаимодействия между молекулами идеального газа отсутствуют, то и его потенциальная энергия равна нулю. Поэтому внутренняя энергия идеального газа зависит только от его температуры.
Поскольку температура идеального газа определяется внутренней кинетической энергией, а температура тела является параметром его состояния, то и внутренняя энергия является параметром его состояния.
Если в результате подвода теплоты рабочее тело переходит из первого состояния во второе, то подводимая теплота q1,2 будет равна u2-u1.
На основании формулы (3) можно записать
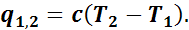
Дата добавления: 2017-02-13; просмотров: 1695;











