Изотермический процесс
Изотермическим процессом называется процесс, протекающий при постоянной температуре: Т= const.
На рис. 10 показана диаграмма изотермического процесса. Процесс расширения газа на диаграмме соответствует переходу из состояния 1 в состояние 2, процесс сжатия — переходу из состояния 2 в состояние 1.
Поскольку в изотермическом процессе Т = const, то уравнение состояния газа pv = RT= const.
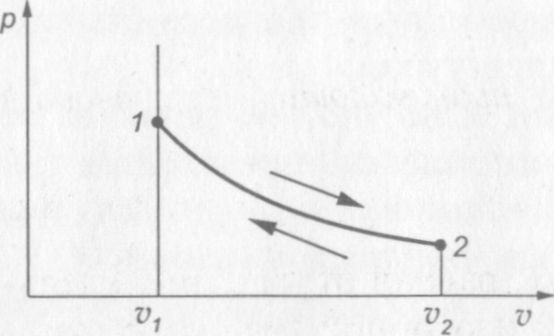
Рис. 10. р— v диаграмма изотермического процесса
В изотермическом процессе в соответствии с законом Бойля—Мариотта справедливо следующее соотношение:
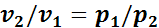 (1.11)
(1.11)
или
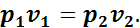
Соотношение (1.11) показывает, что в изотермическом процессе объемы при различных состояниях газа обратно пропорциональны давлениям, соответствующим этим состояниям.
При вычислении внутренней энергии, используя общую формулу (1.6), получим
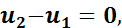
так как
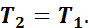
Следовательно, в изотермическом процессе изменение внутренней энергии равно нулю, т. е. внутренняя энергия в течение всего процесса остается постоянной.
Удельная работа изменения объема в изотермическом процессе определяется уравнением
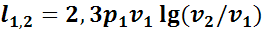
или
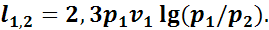 (1.12)
(1.12)
На основании первого закона термодинамики
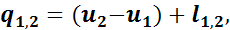
а так как u2 - u1 = 0, то
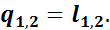
Таким образом, в изотермическом процессе расширения вся подведенная теплота расходуется на внешнюю работу, а при изотермическом процессе сжатия внешняя работа полностью превращается в теплоту.
Адиабатный процесс
Адиабатным процессом называют процесс, протекающий без подвода и отвода теплоты:
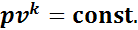 (1.13)
(1.13)
где k — показатель адиабаты — величина, равная отношению удельной изобарной теплоемкости к удельной изохорной теплоемкости:
r w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 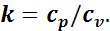
Для идеальных газов k есть величина постоянная, зависящая от природы газа, т. е. от числа атомов в молекуле газа. В табл. 2 приведены значения теплоемкостей ср и сv согласно молекулярно-кинетической теории.
Таблица 2. Значения удельной изобарной и удельной изохорной теплоемкостей и показателя адиабаты в зависимости от числа атомов в молекуле
| Число атомов | сv | ср | k = ср / сv |
| 2,98 | 4,36 | 1,67 | |
| 4,97 | 6,97 | 1,4 | |
| 5,96 | 7,96 | 1,53 |
Протекание адиабатного процесса без теплообмена с окружающей средой может осуществляться в цилиндре, который имеет идеально теплоизолированные стенки. Однако в природе не существует такой изоляции. Поэтому адиабатный процесс есть идеальный процесс и на практике осуществить его невозможно. Реально можно получить процесс с некоторым приближением к идеальному адиабатному процессу. Например, если процессы протекают очень быстро, т. е. в такое короткое время, что газ не успевает принять или передать теплоту стенкам цилиндра.
На рис. 11 представлена р—v диаграмма адиабатного процесса.
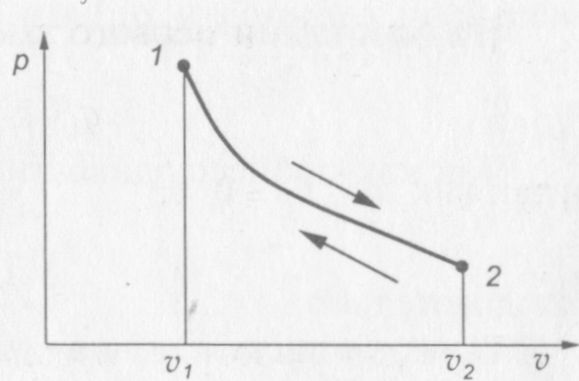
Рис. 11. р— v диаграмма адиабатного процесса
Кривая адиабатного процесса называется адиабатой. Она представляет собой неравнобокую гиперболу.
Зависимость между давлением и объемом для двух точек адиабатного процесса имеет вид
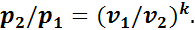 (1.14)
(1.14)
При сравнении формулы (1.14) с формулой (1.13) видно, что при адиабатном расширении газа давление уменьшается интенсивнее, чем при расширении в изотермическом процессе, отсюда следует, что р—v диаграмма адиабаты круче p—v диаграммы изотермы.
Для начального и конечного состояний газа в адиабатном процессе
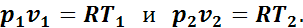
Разделив почленно второе уравнение на первое, получим
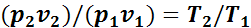
Или
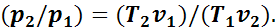
Подставив это выражение в формулу (12), получим
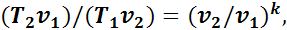
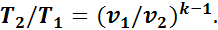 (1.15)
(1.15)
Из уравнения (1.14) следует, что
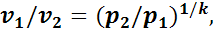
а из уравнения (1.15)
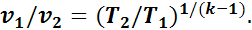
Следовательно,
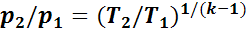
или
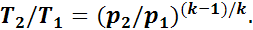 (1.16)
(1.16)
Изменение внутренней энергии определяется формулой
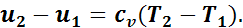
На основании первого закона термодинамики
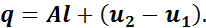
Так как процесс адиабатный, то
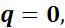
следовательно,
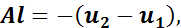
откуда
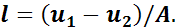
Учитывая, что А — величина постоянная, можно сделать вывод о том, что удельная работа в адиабатном процессе получается только за счет изменения внутренней энергии рабочего тела.
Дата добавления: 2017-02-13; просмотров: 3255;











