Термодинамика газовой коррозии
С термодинамических позиций протекание химической реакции окисления металлов обусловлено изменением свободной энергии Гиббса - ΔGТ (изобарно - изотермического потенциала), являющейся движущей силой процесса. При постоянной температуре и давлении окисление возможно, если ΔGТ<0, и невозможно при ΔGТ>0. Вероятность образования оксидов возрастает при уменьшении величины ΔGТ. Система “металл – оксид – окислитель” находится в равновесии при ΔGТ = 0, когда скорости прямой (образования оксида) и обратной (разложения) реакции равны и роста образовавшегося оксида не происходит. Это равновесие характеризуется константой равновесия реакции, Кр.
Для реакция окисления металла кислородом:
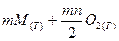 ⇄
⇄ 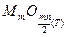 , (2.1)
, (2.1)
в которой активности металла и оксида постоянны и равны 1, изменение энергии Гиббса согласно уравнению изотермы Вант-Гоффа (Р, Т = const):
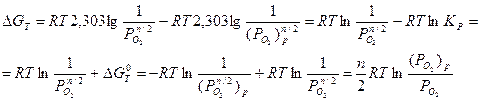 , (2.2) где R = 8,314 Дж/(моль.К) – универсальная газовая постоянная; T – температура, К;
, (2.2) где R = 8,314 Дж/(моль.К) – универсальная газовая постоянная; T – температура, К; 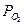 - парциальное давление кислорода в газовой среде;
- парциальное давление кислорода в газовой среде; 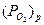 - парциальное давление кислорода в равновесном состоянии, равное давлению (упругости) диссоциации оксида (атм); Кр =
- парциальное давление кислорода в равновесном состоянии, равное давлению (упругости) диссоциации оксида (атм); Кр = 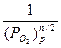 - константа равновесия,
- константа равновесия, 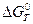 = -RT ln Кр – стандартное изменение энергии Гиббса при температуре Т.
= -RT ln Кр – стандартное изменение энергии Гиббса при температуре Т.
Из уравнения 2.2 следует, что окисление металла термодинамически возможно (ΔGТ<0) при соблюдении условия:
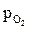 >
> 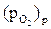 (2.3)
(2.3)
Величина 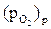 служит мерой термодинамической устойчивости оксида (меньшее значение соответствует большей устойчивости), чем меньше ΔGТ и
служит мерой термодинамической устойчивости оксида (меньшее значение соответствует большей устойчивости), чем меньше ΔGТ и 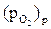 , тем больше сродство металла к окислителю. Условие (2.3) имеет важное практическое значение и является основой выбора безокислительных защитных атмосфер.
, тем больше сродство металла к окислителю. Условие (2.3) имеет важное практическое значение и является основой выбора безокислительных защитных атмосфер.
Равновесное парциальное давление (упругость) диссоциации оксида можно определить из уравнения (2.2):
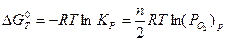 , (2.4) где
, (2.4) где 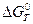 - стандартное изменение энергии Гиббса при
- стандартное изменение энергии Гиббса при 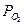 = 1 атм, откуда
= 1 атм, откуда
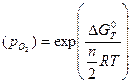 и
и 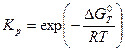 , (2.5)
, (2.5)
Приближенные значения 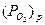 приведены в приложении 1. В уравнении (2.5)
приведены в приложении 1. В уравнении (2.5) 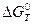 при заданной температуре Т вычисляется по уравнению Гиббса-Гельмгольца:
при заданной температуре Т вычисляется по уравнению Гиббса-Гельмгольца:
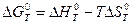 , (2.6) где
, (2.6) где 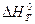 и
и 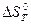 - стандартное изменение энтальпии (тепловой эффект) и энтропии соответственно в результате протекания реакции при заданной Т.
- стандартное изменение энтальпии (тепловой эффект) и энтропии соответственно в результате протекания реакции при заданной Т.
Расчет 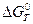 производится на основе таблиц термодинамических величин, методами М.И. Темкина – Д.А. Шварцмана, М.Х. Карапетьянца и др., в т.ч. экспериментально - методом измерения ЭДС гальванического элемента типа М|MO|O2, у которого анод - поверхность металла на границе с оксидной пленкой, где происходит образование катионов и свободных электронов. Катодом является поверхность оксидной пленки на границе с газовой средой, где происходит ассимиляция электронов кислородом. Оксидная пленка имеет как ионную, так и катионную проводимость, и является одновременно как внутренней, так и внешней частью этого гальванического элемента. ЭДС такого элемента определяется как:
производится на основе таблиц термодинамических величин, методами М.И. Темкина – Д.А. Шварцмана, М.Х. Карапетьянца и др., в т.ч. экспериментально - методом измерения ЭДС гальванического элемента типа М|MO|O2, у которого анод - поверхность металла на границе с оксидной пленкой, где происходит образование катионов и свободных электронов. Катодом является поверхность оксидной пленки на границе с газовой средой, где происходит ассимиляция электронов кислородом. Оксидная пленка имеет как ионную, так и катионную проводимость, и является одновременно как внутренней, так и внешней частью этого гальванического элемента. ЭДС такого элемента определяется как:
Еизм = Емах(tк+ tа) = Емах(1 – tе), (2.7) где - Емах – максимальная ЭДС, соответствующая изменению энергии Гиббса в реакции окисления; tк, tа, tе – число переноса катионов, анионов и электронов соответственно (tк + tа + tе = 1).
Пример 1.[*] Определить возможность окисления палладия в воздухе ( 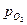 = 0,21 атм) и кислороде при 1123 К, если упругость (давление) диссоциации его оксида
= 0,21 атм) и кислороде при 1123 К, если упругость (давление) диссоциации его оксида 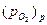 = 0,658 атм (0,667∙105 Па).
= 0,658 атм (0,667∙105 Па).
Решение. Реакция окисления палладия: 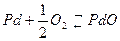 .
.
Т.к. в воздухе Po2 =0,21 атм, (Po2)p> Po2, процесс окисления невозможен.
К этому же приводит расчет изменения энергии Гиббса для реакции окисления:
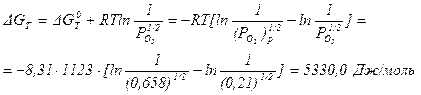
В кислороде процесс окисления возможен: (Po2)p< [Po2 = 1 атм (1,013∙105 Па)]. Расчет энергии Гиббса дает тот же результат:
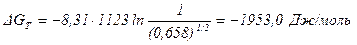 .
.
Влияние температуры на термодинамическую возможность окисления металлов и константу равновесия определяется уравнением изобары Вант-Гоффа:
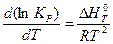 , (2.8)
, (2.8)
Образование оксидов является экзотермическим процессом ( 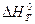 <0) c выделением тепла, поэтому знак производной
<0) c выделением тепла, поэтому знак производной 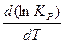 отрицательный, т.е. с ростом температуры происходит уменьшение константы равновесия (функция lnKp = f(T) – убывающая). Поскольку Кр =
отрицательный, т.е. с ростом температуры происходит уменьшение константы равновесия (функция lnKp = f(T) – убывающая). Поскольку Кр = 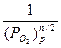 , с увеличением температуры равновесное давление оксида возрастает, а термодинамическая возможность окисления уменьшается. Диссоциация оксида произойдет при температуре диссоциации, когда
, с увеличением температуры равновесное давление оксида возрастает, а термодинамическая возможность окисления уменьшается. Диссоциация оксида произойдет при температуре диссоциации, когда 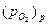 >
> 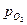 . Выше этой температуры образование оксидной пленки термодинамически невозможно.
. Выше этой температуры образование оксидной пленки термодинамически невозможно.
При комнатных температурах на воздухе ( 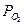 =0,21 атм
=0,21 атм  21278 Па) термодинамически невозможно образование оксидов Au, все остальные металлы окисляются. Температурная зависимость давления диссоциации оксидов металлов, lg
21278 Па) термодинамически невозможно образование оксидов Au, все остальные металлы окисляются. Температурная зависимость давления диссоциации оксидов металлов, lg 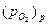 = f(1/T), приведена на рис.2.1. С ростом температуры становятся устойчивыми: Ag при температурах более 420 К, Pd > 1080 K , Ir > 950 K.
= f(1/T), приведена на рис.2.1. С ростом температуры становятся устойчивыми: Ag при температурах более 420 К, Pd > 1080 K , Ir > 950 K.
Без учета взаимодействия компонентов сплава и продуктов окисления, в сплавах избирательно окисляются компоненты, обладающие наибольшим сродством к кислороду (щелочно-земельные и легкие металлы, Cr, Тi и тугоплавкие металлы).
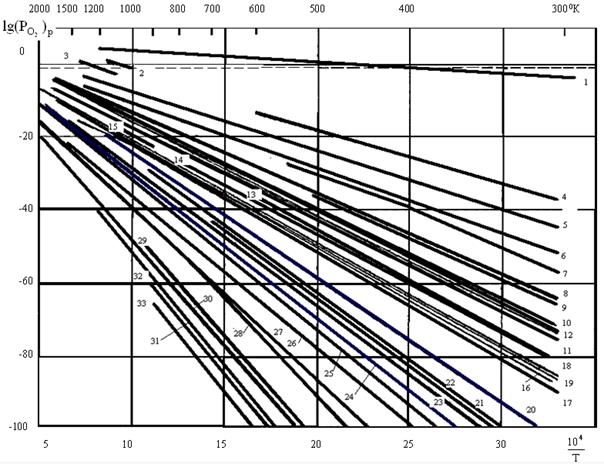
Рис.2.1 Температурная зависимость давления диссоциации оксидов: 1 – Ag2O, 2 – PdO, 3 – IrO2, 4 – PbO2, 5 – CuO, 6 – Cu2O, 7 – Bi2O3, 8 – Co3O4, 9 – As2O3 (орторомбич.), 10 – Sb2O3, 11 – NiO, 12 – CoO, 13 – CdO, 14 – MnO2, 15 – MoO2, 16 – WO2, 17 – Fe3O4, 18 – FeO, 19 – Fe2O3, 20 – Mn2O3, 21 – V2O5, 22 – ZnO, 23 – Mn3O4, 24 – Cr2O3, 25 – V2O4, 26 – MnO, 27 – V2O3, 28 – TiO2, 29 – Al2O3, 30 – ZrO2, 31 – BeO, 32 – MgO, 33 – CaO. Штриховая линия соответствует парциальному давлению кислорода в атмосфере.
Обычно сплавы на основе железа, никеля, меди для повышения жаростойкости легируют металлами, имеющими большее сродство к кислороду сравнительно с металлом основы. Эти легирующие компоненты, избирательно окисляясь, образуют на поверхности оксиды, часто обладающие более высокими защитными свойствами, которые определяются механизмом и кинетикой окисления. Термодинамическая возможность является необходимым, но недостаточным условием для повышения жаростойкости металлов сплавов.
Следует учитывать, что реальная температурная зависимость кинетики окисления, в отличие от термодинамической возможности, иная: термодинамическая нестабильность при повышении температуры снижается, а реальная скорость окисления возрастает (если процесс термодинамически возможен).
При окислении металлов оксиды низшей валентности всегда являются внутренними слоями оксидной пленки (рис. 2.2). При окислении сплава слой оксида металла, имеющего большее сродство к окислителю, всегда будет вблизи металлической поверхности, а внешним слоем – оксид более благородного металла.
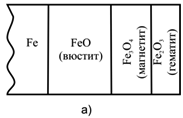
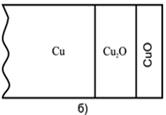
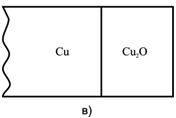
Рис. 2.2 Схема расположения слоев оксидной пленки: а) на железе при Т>570°С на воздухе; б) и в) на меди при 1000°С Ро2 > 13170 Па (0,13 атм) и Ро2 < 13170 Па (0,13 атм).
При расчете равновесного давления кислорода (упругости диссоциации) оксида сплава системы “металлический компонент – оксид компонента” следует учитывать уменьшение активности компонента (аm) в прилегающем к пленке слое сплава. При этом давление кислорода (или – химический потенциал кислорода), на границе “сплав – пленка оксидов элемента”, при окислении возрастает согласно:
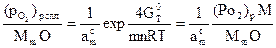 , (2.9)
, (2.9)
где 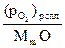 - равновесное давление кислорода в системе “сплав – оксидная пленка” при активности окисляющегося металлического компонента M;
- равновесное давление кислорода в системе “сплав – оксидная пленка” при активности окисляющегося металлического компонента M; 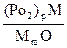 - равновесное давление кислорода в системе “неблагородный металл – оксидная пленка”, т.е. аm = 1; с – стехиометрический коэффициент перед металлом в химическом уравнении (стехиометрический коэффициент перед кислородом равен 1).
- равновесное давление кислорода в системе “неблагородный металл – оксидная пленка”, т.е. аm = 1; с – стехиометрический коэффициент перед металлом в химическом уравнении (стехиометрический коэффициент перед кислородом равен 1).
Например, при окислении железа, находящегося в сплаве: 2Fe + O2 → 2FeO, с=2. Значения равновесных давлений кислорода приведены в приложении (таблица 2).
Высокотемпературное окисление приводят не только к образованию оксидов на поверхности, но и к растворению газов в металле, существующих в виде ионов (твёрдый раствор внедрения), или в виде молекул в микротрещинах и порах.
Термодинамическая возможность самопроизвольного протекания процесса образования твёрдого раствора газа в металле определяется знаком изменения энергии Гиббса. Для реакции 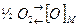 процесс возможен, если
процесс возможен, если 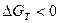 , т.е.
, т.е.
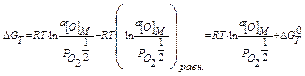 , (2.10)
, (2.10)
где 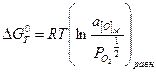 ,
, 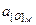 - активность кислорода в твёрдом растворе, равная:
- активность кислорода в твёрдом растворе, равная:
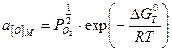 (2.11)
(2.11)
Это выражение закона Сиверста при атомарном растворении идеального двухатомного газа в металле. При растворении газа молекулярно 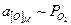 .
.
Термодинамические расчёты позволяют оценить: возможность окисления металла и движущую силу процесса; наиболее вероятный фазовый состав продуктов взаимодействия с окислителем; расположение оксидных слоёв в плёнке и направление изменения градиента химического потенциала окислителя (давление окислителя) и металла в плёнке; возможность образования твёрдого раствора окислителя в металле.
Дата добавления: 2017-02-13; просмотров: 4291;











