Парадокс Гиббса. К вопросу об аддитивности энтропии.
Формула (1) написана для 1 моля вещества, если же рассматриваем не 1 моль, тогда она примет следующий вид:
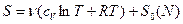
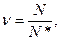 где N* - число Авогадро.
где N* - число Авогадро.
Теперь пусть имеется сосуд, разделённый перегородкой на две равные части объёмом V каждая, N1=N2=N.
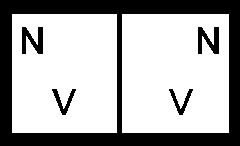
Если убрать перегородку, физическое состояние системы остаётся неизменным (тот же газ, те же параметры), естественно ожидать, что энтропия останется неизменной. Проверим:
1) до слияния
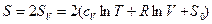 (2)
(2)
2) после слияния
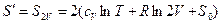 . (3)
. (3)
Учтём что cV ~ N, R ~ N, (S0 – также ~ N, т.к. выражение (*) можем поделить на N). Тогда (3)-(2):
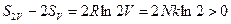 (4)
(4)
Получили возрастание энтропии. Но система то одна! Парадокс Гиббса.
В чём дело? Гиббс предложил следующее:
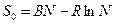 (5)
(5)
где S0не зависит от Т и V = const.
Тогда 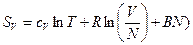 и
и 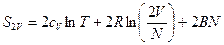 и S2V = 2SV, парадокса нет, энтропия аддитивна. Но почему? Посмотрим на выражение для энтропии, которое из статистики. Была формула для F (F=U-TS) :
и S2V = 2SV, парадокса нет, энтропия аддитивна. Но почему? Посмотрим на выражение для энтропии, которое из статистики. Была формула для F (F=U-TS) :
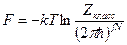 и
и 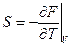
Было: 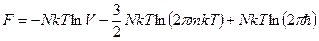 .
.
Отсюда:
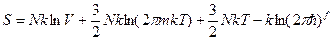 (6)
(6)
(легко видать)
Сравним (6) и (1), (6) и (5) – отсутствует слагаемое с lnV. Почему? Т.е. или термодинамика, или классическая статистика не дают полного описания. Приходится опять возвращаться к вопросам нормировки функции распределения, что мы уже делали. Итак, если газ один, то нужно воспользоваться принципом тождественности частиц: если переставить 2 (поменять местами) частицы местами, то микросостояние системы не изменится (это не выполняется для различных газов),т.е. число микросостояний меньше, чем при прямом интегрировании.
Было: 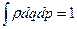 , потом
, потом 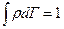 , где
, где 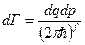 - число микросостояний. А теперь учтём тождественность и поделим дополнительно на число перестановок (их N! штук):
- число микросостояний. А теперь учтём тождественность и поделим дополнительно на число перестановок (их N! штук):
Итак: 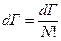 (7), и это надо сделать для всего.
(7), и это надо сделать для всего.
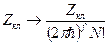 (было без N!).
(было без N!).
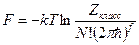 (8)
(8)
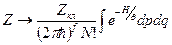 . Учтём, что при N >> 1 справедлива формула Стирлинга (логарифм Стирлинга):
. Учтём, что при N >> 1 справедлива формула Стирлинга (логарифм Стирлинга): 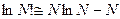 . Тогда из (8) для S имеем:
. Тогда из (8) для S имеем:
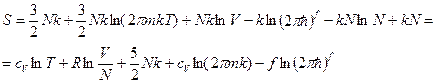 ,
,
где f ~ N. В результате S ~ N, аддитивная. 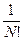 можно не учитывать, если число частиц в системе постоянно. В противном же случае следует учитывать этот множитель.
можно не учитывать, если число частиц в системе постоянно. В противном же случае следует учитывать этот множитель.
Дата добавления: 2021-05-28; просмотров: 576;











