Сложные эфиры, имеющие приятный аромат
| Формула | Название | Аромат |
| НСООС2Н5 | Этилформиат | рома |
| СзН7СООС2Н5 | Этилбутаноат | ананаса |
| НСООС5Н9 | Пентилформиат | вишни |
| СН3СООС5Нв | Пентилацетат | банана |
| СН3СООС8Н17 | Октилацетат | апельсина |
Гидролиз сложных эфиров. Реакция расщепления сложных эфиров на кислоту и спирт при действии воды происходит и в кислой, и в щелочной среде. Однако в присутствии щелочи реакция гидролиза (омыления) необратима, так как получается соль карбоновой кислоты, содержащая устойчивый ацилат-анион:
 |
Реакция гидролиза сложных эфиров обратима реакции этерификации.
В отличие от обычных сложных эфиров, карбонильный атом углерода в тиоэфирах несет больший положительный заряд, что делает их более реакционноспособными. Вследствие этого связь С—S в ацилкоферменте А - макроэргическая. При гидролизе ацетилко-фермента А выделяется даже несколько большая энергия, чем при гидролизе АТФ (AG° = -32,9 и -30,5 кДж/моль соответственно):
 |
ацетилкофермент А уксусная кофермент А
кислота
Это обстоятельство способствует активности ацилкоферментов А в реакциях, протекающих в организме с их участием.
Ацилирование спиртов сложными эфирами. Сложные эфиры взаимодействуют со спиртами с образованием нового сложного эфира. Эта реакция называется переэтерификацией, а в биохимии ее называют реакцией трансацилирования. Реакция трансацилирования обычно катализируется кислотами, и в этих случаях она обратима
 |
 |
В организме реакция трансацилирования (переэтерификации) катализируется ферментами трансферазами, которые способствуют переносу ацилов от сложных эфиров на спирты, амины и другие субстраты. Источником ацилов обычно являются ацилкоферменты А, т. е. тиоэфиры карбоновых кислот. Одним из примеров реакции трансацилирования является синтез ацетилхолина с помощью ацетилкофермента А:
ацетилкофермент А холин
 |
ацетилхолин кофермент А
 |
Ацилирование аминов сложными эфирами. Сложные эфиры взаимодействуют с аммиаком или аминами (реакция аминолиза) с образованием амидов соответствующих карбоновых кислот:
Кроме реакций нуклеофильного замещения (гидролиза и ацилирования) молекулы сложных эфиров вступают в реакции конденсации друг с другом с образованием связи С—С. В образовании новой связи участвуют углеродный атом карбонильной группы одной молекулы эфира и α-углеродный атом другой молекулы эфира. Эта реакция конденсации (С-ацилирования) сопровождается окислительно-восстановительными превращениями.
Амиды 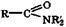 . В молекулах амидов имеет место сопряжение неподеленной электронной пары атома азота с π-системой двойной связи С=О (р, π-сопряжение). В результате связь С—N в амидах становится короче, чем в аминах, а длина связи С=О такая же, как в карбоновых кислотах, где имеет место аналогичное р, л-сопряжение. Благодаря сопряжению атомы амидной группировки находятся в одной плоскости и вращение по амидной связи С—N в значительной степени заторможено, так как эта связь имеет частично характер двойной связи.
. В молекулах амидов имеет место сопряжение неподеленной электронной пары атома азота с π-системой двойной связи С=О (р, π-сопряжение). В результате связь С—N в амидах становится короче, чем в аминах, а длина связи С=О такая же, как в карбоновых кислотах, где имеет место аналогичное р, л-сопряжение. Благодаря сопряжению атомы амидной группировки находятся в одной плоскости и вращение по амидной связи С—N в значительной степени заторможено, так как эта связь имеет частично характер двойной связи.
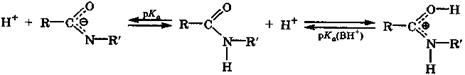
|
Основность амидов [рКа(ВН+) = 0 ÷ -2] выше, чем сложных эфиров [рКа(ВН+) = -5 ÷ -6]. В то же время их основность значительно меньше основности аминов [рКа(ВН+) = 5 ÷ 10] ввиду иной гибридизации атомных орбиталей атома азота, способствующей сильному взаимодействию неподеленной электронной пары атома азота с двойной связью карбонильной группы. Если в молекуле амида имеется связь N—Н, то возможна его кислотная ионизация. Амиды являются слабыми NH-кислотами (рКа = = 13 ÷ 15), и их кислотность сравнима с кислотностью спиртов.
анион амида амид катион амида
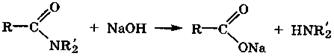
|
Реакции нуклеофильного замещения. Амиды в присутствии щелочи или кислоты легко гидролизуются:
В кислой среде вследствие протонирования молекула амида активируется и может ацилировать спирты, образуя сложный эфир карбоновой кислоты и амин:
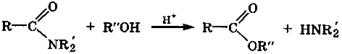
|
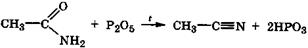
|
Реакции с электрофильными реагентами. Электрофильные реагенты атакуют в амидах кислородный атом карбонильной группы. Так, при нагревании амидов с сильными электрофилами (P2O5, РОС13) происходит внутримолекулярное отщепление молекулы воды с образованием нитрилов карбоновых кислот:
ацетамид ацетонитрил
§ 5.6. Отдельные представители амидов кислот.
(Материал для самостоятельной подготовки)
Амиды угольной кислотыимеют очень большое значение. Как и все двухосновные кислоты угольная кислота дает неполный амид, называемый карбаминовой кислотой, и полный амид, называемый мочевиной H2N-C-NH2.
׀׀
О
Мочевина в организме человека и млекопитающих животных является конечным продуктом азотистого обмена. Такие азотистые вещества, как белки и амирокислоты, претерпев в организме ряд превращений, в конце концов, выделятся с мочой в виде мочевины. В течение суток организм человека выделяет с мочой 20-30 г мочевины.
В настоящее время в медицине применяют ряд ценных лекарственных веществ, в основе которых лежат амиды кислот, такие как бутамид, букарбан, хлорпропамид, глибенкламид и др., которые используются в качестве противодиабетических препаратов. Мочевина применяется как осмотический диуретик.
Очень важное значение амиды имеют в стоматологической практике. Большинство стоматологических вмешательств сопровождается болевыми ощущениями большей или ме- ньшей интенсивности, поэтому анестезия – одна из наиболее актуальных прблем стоматологии. Учитывая высокую потребность в более совершенных местнообезболивающих препаратах, их разрабатывают ученые всех стран мира. Изучение полученных средств позволило заключить, что более длительно воздействуют местные анестетики группы амидов. В 1946 году шведскими учеными Lofgren и Lundquist был синтезирован местный анестетик, относящийся к группе амидов - ксилокаин (лидокаин), который сразу же стал вытеснять новокаин.Спустя несколько лет были синтезированы меливакаини в 1976 году – артикаин (ультракаин) – анестетик с уникальными свойствами. Ультракаин позволяет не только качественно и длительно обезболить стоматологическую процедуру, но и сократить количество посещений врача. Артикаин в 5 раз сильнее новокаина и в 2-3 раза сильнее популярных лидокаина и тримекаина. При некоторых видах анестезии длительность эффекта достигает 5-6 часов. Низкая токсичность ультракаина, безопасность и хорошая переносимость позволяет осуществлять длительные процедуры с его использованием.
Нитрилы R—C=N. Нитрилы являются очень слабыми N-ocнованиями [рКа(ВН+) ≈ -10], поскольку их атом азота имеет sp-гибридизацию. Поэтому он более электроотрицателен и значительно сильнее удерживает свою неподеленную электронную пару, чем атом азота в других азотсодержащих соединениях.
Нитрилы легко подвергаются гидратации в кислой или щелочной среде за счет нуклеофильного присоединения воды к сильнополярной тройной связи C=N с образованием амида соответствующей кислоты.
Ацилирующего действия нитрилы не проявляют. Подобно другим производным карбоновых кислот нитрилы за счет α-водородного атома являются слабыми С—Н-кислотами, образующими карбанион на α-углеродном атоме. Такой карбанион легко присоединяется к карбонильным соединениям по реакции типа альдольной конденсации.
Дата добавления: 2019-09-30; просмотров: 600;











