Реакции нуклеофильного замещения, нуклеофильного присоединения
( реакции присоединения-отщепления).
Реакции нуклеофильного замещения с участием 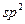 - гибридизованного атома углерода. Механизм реакций этого типа рассмотрим на примере взаимодействия карбоновых кислот со спиртами (реакция этерификации). В карбоксильной группе кислоты реализуется p,
- гибридизованного атома углерода. Механизм реакций этого типа рассмотрим на примере взаимодействия карбоновых кислот со спиртами (реакция этерификации). В карбоксильной группе кислоты реализуется p,  -сопряжение, поскольку пара электронов атома кислорода гидроксильной группы ОН вступает в сопряжение с двойной углерод-кислородной связью (
-сопряжение, поскольку пара электронов атома кислорода гидроксильной группы ОН вступает в сопряжение с двойной углерод-кислородной связью (  -связью):
-связью):
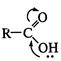
Такое сопряжение является причиной, с одной стороны, повышенной кислотности карбоксильных соединений, а с другой — уменьшения частичного положительного заряда ( 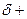 ) на атоме углерода карбоксильной группы (
) на атоме углерода карбоксильной группы ( 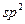 -гибридизованном атоме), что значительно затрудняет непосредственную атаку нуклеофила. С целью увеличения заряда на атоме углерода используют дополнительное протонирование — кислотный катализ (стадия I):
-гибридизованном атоме), что значительно затрудняет непосредственную атаку нуклеофила. С целью увеличения заряда на атоме углерода используют дополнительное протонирование — кислотный катализ (стадия I):


На стадии II происходит атака нуклеофила (молекулы спирта 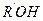 ), протонирование гидроксильной группы с образованием хорошоуходящей группы
), протонирование гидроксильной группы с образованием хорошоуходящей группы  , на стадии III — ее отщепление и а стадии IV — регенерация протона — возврат катализатора с образованием конечного продукта — сложного эфира. Реакция обратима, что наблюдается при гидролизе сложных эфиров, гидролизе жиров в биосистемах.
, на стадии III — ее отщепление и а стадии IV — регенерация протона — возврат катализатора с образованием конечного продукта — сложного эфира. Реакция обратима, что наблюдается при гидролизе сложных эфиров, гидролизе жиров в биосистемах.
Реакции нуклеофильного присоединения. Наиболее характерны реакции нуклеофильного присоединения (  ) для оксосоединений - альдегидов и кетонов. Механизм этих реакций имеет общие черты, это двухстадийный ионный процесс. Первая стадия (лимитирующая) представляет собой обратимую атаку нуклеофилом Nu: с образованием так называемого тетраэдрического интермедиата. Вторая стадия — быстрая атака электрофилом:
) для оксосоединений - альдегидов и кетонов. Механизм этих реакций имеет общие черты, это двухстадийный ионный процесс. Первая стадия (лимитирующая) представляет собой обратимую атаку нуклеофилом Nu: с образованием так называемого тетраэдрического интермедиата. Вторая стадия — быстрая атака электрофилом:
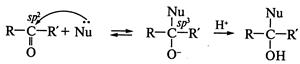
На реакционную способность оксосоединения оказывает влияние природа групп R и  . Так, введение электронодонорных заместителей снижает реакционную способность, а электроноакцепторных — усиливает. Поэтому альдегиды более активны в реакциях
. Так, введение электронодонорных заместителей снижает реакционную способность, а электроноакцепторных — усиливает. Поэтому альдегиды более активны в реакциях 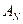 , чем кетоны. Кроме того, реакционная способность зависит от природы нуклеофила. Например, тиолы RSH, являясь более сильными нуклеофилами, чем спирты ROH, вступают в реакцию
, чем кетоны. Кроме того, реакционная способность зависит от природы нуклеофила. Например, тиолы RSH, являясь более сильными нуклеофилами, чем спирты ROH, вступают в реакцию 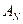 как с альдегидами, так и с кетонами, образуя устойчивые к гидролизу тиоацетали, тогда как ацетали — продукты присоединения спиртов к альдегидам — к гидролизу не устойчивы:
как с альдегидами, так и с кетонами, образуя устойчивые к гидролизу тиоацетали, тогда как ацетали — продукты присоединения спиртов к альдегидам — к гидролизу не устойчивы:


Обратите внимание, что последние стадии процесса представляют собой атаку нуклеофила (молекулы спирта 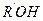 ) на электрофильный реакционный центр (карбкатион) и идут по механизму нуклеофильного замещения
) на электрофильный реакционный центр (карбкатион) и идут по механизму нуклеофильного замещения 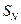 . Образующиеся промежуточные соединения — полуацетали — являются неустойчивыми. Стабилизация их возможна только в циклической форме при образовании циклических полуацеталей, например 5-гидроксипентаналя:
. Образующиеся промежуточные соединения — полуацетали — являются неустойчивыми. Стабилизация их возможна только в циклической форме при образовании циклических полуацеталей, например 5-гидроксипентаналя:

Другой пример биологически важной реакции этого типа — присоединение аминов и некоторых других азотсодержащих соединений к карбонильным соединениям — альдегидам и кетонам. Реакция идет по механизму нуклеофильного присоединения—элиминирования ( 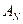 —E), или нуклеофильного присоединения- отщепления:
—E), или нуклеофильного присоединения- отщепления:
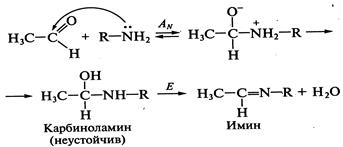
Другие азотсодержащие соединения, выступающие в этих реакциях в роли нуклеофила: гидразин 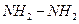 , гидроксиламин
, гидроксиламин 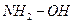 , фенилгидразин
, фенилгидразин  .
.
Продуктами реакций 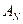 —Е в этих случаях являются соединения общей формулы
—Е в этих случаях являются соединения общей формулы

называемые гидразонами (X = 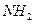 ), оксимами (X = ОН), фенил-гидразонами (X =
), оксимами (X = ОН), фенил-гидразонами (X = 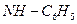 ), иминами (X = R), что будет более подробно рассмотрено в соответствующих разделах.
), иминами (X = R), что будет более подробно рассмотрено в соответствующих разделах.
Помимо указанных реакций присоединения возможны реакцииAdR - свободнорадикального присоединения и полимеризации или поликонденсации.
AdR - свободнорадикальное присоединение
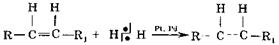
|
Дата добавления: 2019-09-30; просмотров: 784;











