Общая характеристика реакционной способности
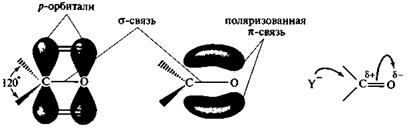
Тригональный sр2-гибридизованный атом углерода карбонильной группы образует три σ-связи, лежащие в одной плоскости, и π-связь с атомом кислорода за счет негибридизованной р-орбитали. Вследствие различия в электроотрицательности атомов углерода и кислорода π-связь между ними сильно поляризована (рис. 8).
|
Рис. 8. Строение карбонильной группы, определяющее ее взаимодействие с нуклеофильными реагентами
В результате на атоме углерода карбонильной группы возникает эффективный положительный заряд δ+, а на атоме кислорода — отрицательный заряд δ–.
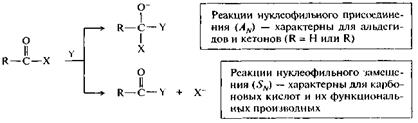
Поскольку атом углерода электронодефицитен, то он представляет собой удобный центр для нуклеофильной атаки. Эта атака в зависимости от природы заместителя X в карбонильном соединении R—СО—X приводит к различным результатам — присоединению по двойной связи С=О (нуклеофильное присоединение, X = Н или R) или замещению X на Y (нуклеофильное замещение, X = ОН, OR, NH2, Hal и др.).
В кислой среде активность карбонильной группы, как правило, увеличивается, поскольку вследствие протонирования атома кислорода на атоме углерода возникает полный положительный заряд.
>С=О + Н+ <=> > 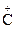 −ОН
−ОН
Кислотный катализ используют обычно в тех случаях, когда атакующий нуклеофил обладает низкой активностью.
Таким образом, для соединений, содержащих карбонильную группу >С=О, характерны следующие типы реакций:
• нуклеофильного присоединения AN - для альдегидов и кетонов;
• нуклеофильного замещения SN - для карбоновых кислот и их функциональных производных.
В зависимости от природы органических радикалов альдегиды и кетоны могут принадлежать к алифатическому(жирному) или ароматическому ряду. Кетоны бывают смешанными. отдельные представители альдегидов и кетонов представлены в табл. 11.
Алифатические Ароматические Жирно-ароматические
О О О О
|| || || ||
СН3−С−Н СН3−С− СН3 С6Н5 −С−Н С6Н5 −С− СН3
ацетальдегид ацетон бензальдегид метилфенилкетон
Альдегиды и кетоны — полярные соединения, у которых в жидкой фазе имеет место диполь-дипольное взаимодействие молекул друг с другом. Поэтому альдегиды и кетоны имеют более высокие температуры кипения, чем неполярные соединения, например углеводороды с близкой молекулярной массой. Однако в отличие от спиртов и карбоновых кислот, в их молекулах отсутствуют связанные с атомами кислорода высоко подвижные атомы водорода. В связи с этим альдегиды и кетоны не ассоциированы за счет образования водородных связей.
Таблица 11
Альдегиды и кетоны
| Отдельные представители | Физические свойства | ||
| название | формула | т. пл., °С | т. кип., °С |
| Альдегиды | |||
| Метаналь (муравьиный альдегид, формальдегид) | НС(О)Н | -92 | -21 |
| Этаналь (уксусный альдегид, ацетальдегид) | СН3С(О)Н | -121 | |
| Пропаналь (пропионовый альдегид) | СН3СН2С(О)Н | -81 | |
| Бутаналь (н-масляный альдегид) | СН3СН2СН2С(О)Н | -99 | |
| Пропеналь (акролеин) | СН2=СНС(О)Н | -88 | |
| Бутен-2-аль (кротоновый альдегид) | СН3СН=СНС(О)Н | -69 | |
| Бензальдегид | С6Н5С(О)Н | -26 | |
| Кетоны | |||
| Пропаном (ацетон) | СН3С(О)СН3 | -94 | |
| Бутанон-2 (метилэтилкетон) | СН3С(О)СН2СН3 | -86 | |
| Ацетофенон (метилфенилкетон) | CH3C(О)C6 H5 |
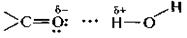
|
Как соединения, склонные к образованию водородной связи, альдегиды и кетоны могут взаимодействовать с молекулами воды и поэтому хорошо в ней растворяются (особенно первые члены гомологического ряда).
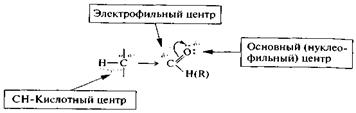
|
Схематически распределение электронной плотности в альдегидах и кетонах с учетом передачи электронного влияния электронодефицитного атома углерода карбонильной группы по σ-связям представлено ниже (атом водорода может быть замещен на органический радикал, указанный в скобках).
Наличие в молекуле альдегида или кетона электрофильного центра — атома углерода карбонильной группы — предопределяет возможность нуклеофильной атаки. Местом электрофильной атаки служит основный (нуклеофильный) центр — атом кислорода карбонильной группы. Кроме того, в альдегидах и кетонах имеется слабый СН-кислотный центр, атом водорода которого обладает определенной протонной подвижностью и может, в частности, подвергаться атаке основанием.
Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины эффективного положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды. С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина δ+ на нем в альдегидах и кетонах убывает в следующем ряду.
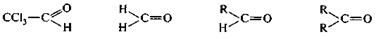
|
Уменьшение эффективного заряда (δ+) на карбонильном атоме углерода
——————————————————————————————→
–I  +IН=0 +IR(R=Alk) +I-эффект двух R-групп
+IН=0 +IR(R=Alk) +I-эффект двух R-групп
Увеличение пространственной затрудненности для нуклеофильной атаки
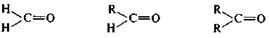
|
——————————————————————————————→
Пространственная доступность карбонильного атома углерода уменьшается при замене водорода на более объемистые органические радикалы. Поэтому альдегиды более реакционноспособны, чем кетоны.
Общая схема реакций нуклеофильного присоединения AN к карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединение электрофила к атому кислорода.
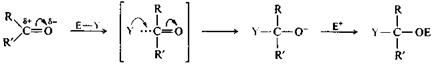
|
альдегид (R = Н) переходное продукт
или кетон состояние присоединения
Процесс напоминает бимолекулярное замещение SN2, но с тем отличием, что принимающий пару электронов атом кислорода не является здесь уходящей группой, а остается в молекуле субстрата.
Карбонильный атом углерода имеет плоскую конфигурацию, поэтому нуклеофильная атака равновероятна с обеих сторон плоскости.
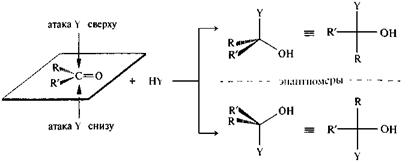
|
В тех случаях, когда карбонильный атом углерода является прохиральным центром и в результате реакции возникает хиральный атом углерода, энантиомеры образуются в равных количествах, т. е. получается рацемическая смесь. Следовательно, в обычных условиях, вне организма, эта реакция протекает нестереоселективно.
§4.2. Химические свойства альдегидов и кетонов.
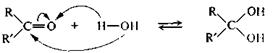
|
Присоединение воды.Присоединение воды к карбонильной группе — гидратация — обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата. Продукт гидратации, как правило, в свободном виде выделить с помощью перегонки не удается, так как он разлагается на исходные компоненты. Формальдегид в водном растворе гидратирован более чем на 99,9%, ацетальдегид — приблизительно наполовину, ацетон практически не гидратирован.
Положение равновесия реакции гидратации указанных соединений можно объяснить с учетом пространственного фактора. Так, образование гидрата ацетона невыгодно, поскольку при этом возрастает стерическое отталкивание между объемистыми заместителями за счет уменьшения угла между ними от -120 до -109,5°.
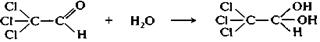
|
Трихлороуксусный альдегид (хлораль) гидратирован полностью. Наличие электроноакцепторной трихлорометильной группы настолько стабилизирует хлоральгидрат, что это кристаллическое вещество отщепляет воду только при перегонке в присутствии водоотнимающих веществ (H2SO4 и др.).
хлораль хлоральгидрат
Другой стабильный гидрат — нингидрин — используется в качестве реактива для обнаружения α-аминокислот.
Присоединение спиртов.Спирты при взаимодействии с альдегидами легко образуют полуацетали. При обработке полуацеталей избытком спирта в кислой среде могут быть получены ацетали (реакция напоминает синтез простых эфиров из спиртов). Схема процесса может быть записана следующим образом:
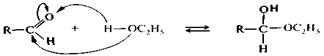
|
альдегид полуацеталь
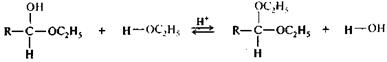
|
полуацеталь ацеталь
|
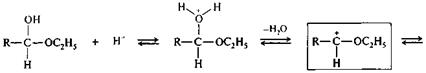
Роль кислотного катализа при превращении полуацеталя в ацеталь становится ясной из приведенной ниже схемы механизма реакции. Центральное место в схеме занимает образование карбокатиона (I), стабилизированного за счет участия пары электронов соседнего атома кислорода (+М-эффект С2Н5О-группы).
полуацеталь (I)
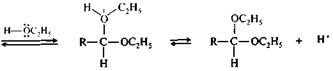
|
ацеталь
Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы, так как алкоксид-ион является более трудно уходящей группой, чем гидроксид-ион. Кетоны в аналогичных условиях кеталей не образуют.
Следует отметить, что образование ацеталей часто используется в органическом синтезе как временная защита альдегидной группы.
Присоединение тиолов.Тиолы активнее спиртов в реакциях с альдегидами и кетонами. Они образуют соответствующие тиоаналоги — полутиоацетали и дитиоацетали.
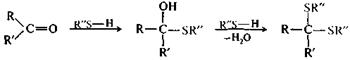
|
альдегид (R=H) полуацеталь дитиоацеталь
или кетон
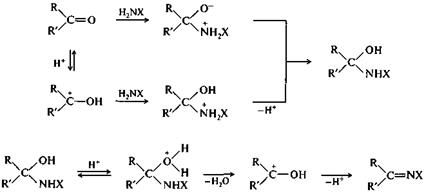
Присоединение аминов и их производных.Амины и другие азотсодержащие соединения общего вида NH2X реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. Поэтому данный процесс в целом классифицируют как реакцию присоединения—отщепления.
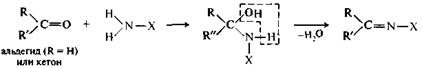
|
Амины и их производные реагируют с альдегидами и кетонами с образованием разнообразных соединений. В случае первичных аминов получаются имины (их называют также основаниями Шиффа).
Имины — промежуточные продукты во многих ферментативных процессах, например биосинтезе α-аминокислот в организме. Получение иминов протекает через стадию образования карбиноламинов, которые в некоторых случаях относительно устойчивы, например при взаимодействии формальдегида с α-аминокислотами.
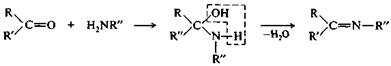
|
альдегид (R=H) первичный карбиноламин имин
или кетон амин
Имины являются промежуточными продуктами в общем способе получения аминов из альдегидов и кетонов путем восстановительного аминирования. Этот способ заключается в восстановлении смеси карбонильного соединения с аммиаком (или амином). Процесс протекает по схеме присоединения—отщепления с образованием имина, который затем восстанавливается в амин. Восстановительное аминирование осуществляется в организме в ходе синтеза α-аминокислот.
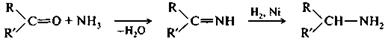
|
альдегид (R=H) имин амин
или кетон
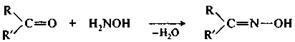
|
При взаимодействии альдегидов и кетонов с гидроксиламином получаются оксимы, с производными гидразина — гидразоны. Эти реакции могут быть использованы для выделения альдегидов и кетонов из реакционной смеси и их идентификации, поскольку образующиеся производные, как правило, представляют собой кристаллические вещества с четкими температурами плавления.
альдегид (R=H) гидроксиламин оксим
или кетон
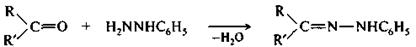
|
альдегид (R=H) фенилгидразин фенилгидразон
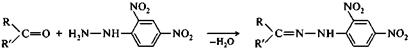
|
или кетон
альдегид (R=H) 2,4-динитрофенилгидразин 2,4-динитрофенилгидразон
или кетон
Основания Шиффа и другие подобные соединения легко гидролизуются водными растворами минеральных кислот с образованием исходных продуктов.
В большинстве случаев для реакций альдегидов и кетонов с азотистыми основаниями необходим кислотный катализ, ускоряющий дегидратацию продукта присоединения. Однако если слишком повысить кислотность среды, то реакция замедлится в результате превращения азотистого основания в нереакционноспособную сопряженную кислоту XNH3+. Поэтому оптимальным обычно является проведение процесса при рН, близком рКа этой сопряженной кислоты, т. е. в условиях, когда приблизительно половина азотистого основания остается в непротонированной форме. В случае низкоосновных азотистых оснований за счет кислотного катализа также происходит протонирование карбонильной группы субстрата, что повышает электрофильность карбонильного атома углерода и тем самым способствует его реакции с этими слабыми нуклеофилами.
|
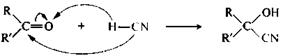
|
Присоединение циановодородной кислоты.В присутствии следов щелочи циановодородная кислота присоединяется к альдегидам и кетонам с образованием α-гидроксинитрилов (циангидринов).
альдегид (R=H) α-гидроксинитрил
или кетон
Эта реакция лежит в основе специфических методов получения α-гидрокси- иα-аминокислот.
|
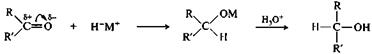
Присоединение гидридов металлов.Восстановление альдегидов и кетонов осуществляют с помощью комплексных гидридов металлов LiAlH4, KBH4. Реакция включает нуклеофильную атаку карбонильного атома углерода гидрид-ионом. При последующем гидролизе образовавшегося алкоголята получается первичный или вторичный спирт.
альдегид (R=H) комплексный первичный или
или кетон гидрид металла вторичный спирт
Дата добавления: 2019-09-30; просмотров: 972;











