Способы выражения количественного
Состава растворов
Количественный состав раствора определяется концентрацией, т.е. относительным содержанием каждого из компонентов, составляющих раствор.
Растворы с большой концентрацией вещества называются концентрированными, с малой - разбавленными.
Известно много способов выражения концентрации, основанных на постоянстве количества раствора, растворенного вещества, растворителя или объема раствора.
При постоянном количестве раствора концентрации выражаются в процентах и в долях.
Весовые проценты. Концентрация выражается числом весовых частей растворенного вещества в 100 весовых частях раствора. Например, 10 % раствор NaCl - это смесь 10 г NaCl и 90 г H2O.
Молекулярные проценты. Концентрация выражается числом грамм - молекул (молей) растворенного вещества M в 100 - M молях растворителя.
Концентрация 40 % - ного раствора H2SO4 в молях % вычисляется следующим образом:
100 ∙ 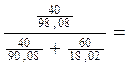 10,91 моль % H2SO4
10,91 моль % H2SO4
100 - 10,91 = 89,09 моль % H2O
здесь 98,08 и 18,02 - молярные веса соответственно H2SO4 и H2O
Атомные проценты. Определяется числом n - атомов растворенного компонента m, приходящихся на 100 - m грамма растворителя.
Для сплава, содержащего 66,7 % Na и 33,3 % К состав компонентов в весе % вычисляется следующим образом:

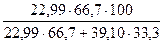 = 54,08 веса % Na
= 54,08 веса % Na
100 – 54,08 = 45,92 веса % К
здесь 22,99 и 39,10 – атомные веса соответственно Na и К.
Весовая доля, мольная доля, атомная доля составляет соответственно одну сотую от весовых, молекулярных и атомных процентов.
При постоянном количестве растворителя концентрация выражается моляльностью и числом граммов растворенного вещества на 1 кг растворителя.
Моляльность.Концентрация определяется числом молей (m) растворенного вещества в 1 кг растворителя.
Например, 2 m H2SO4, значит, что на 1000 г H2O приходится 2 г - м H2SO4 или 196 г H2SO4
При постоянном объеме раствора концентрация выражается через молярность, нормальность и титральность.
Молярность. Концентрация определяется числом молей растворенного вещества (M), содержащихся в 1 л. раствора. Так, одномолярный раствор обозначается 1 М и т.д. Например, 2 M раствор H2SO4, значит в л раствора содержится 2 г - моль H2SO4 или 2 ∙ 98 = 196 г H2SO4
Нормальность. Концентрация определяется числом 2 эквивалентов растворенного вещества, содержащихся в 1 л раствора. Так 2 н H2SO4 , значит, что в 1 л раствора содержится 2 г - эквивалента H2SO4. 1 г – эквивалент H2SO4 равен 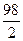 = 49 г. 49 ∙ 2 = 98 г H2SO4
= 49 г. 49 ∙ 2 = 98 г H2SO4
Титральность. Концентрация определяется количеством грамма вещества, содержащегося в 1 см3 раствора (1 мл.)
Дата добавления: 2016-12-09; просмотров: 5348;











