Константы равновесия гетерогенных реакций
Гетерогенные реакции – это реакции, в которых реагирующие вещества находятся в разных фазах. В выражения для констант равновесия гетерогенных реакций входят концентрации (парциальные давления или количества вещества) только газообразных или растворенных веществ. Например, для реакции
S(тв) + О2(г) = SO2(г)
константа равновесия, выраженная через приведенные давления
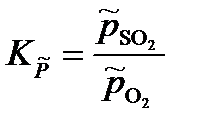
Для реакции
S2(г) + Fe(тв) = FeS(тв)
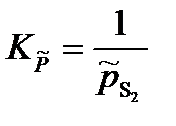
Пример:Определим равновесные парциальные давления газообразных веществ при температуре 800 К и нормальном атмосферном давлении в реакции
WO3 + 3H2 = W + 3H2O,
если константа равновесия реакции при температуре 800 К и атмосферном давлении 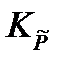 = 2,59·10-2.
= 2,59·10-2.
Решение:
Запишем выражение для константы равновесия химической реакции через приведенные парциальные давления газообразных веществ
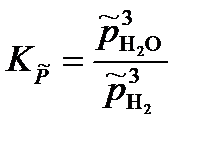
Так как в уравнении два неизвестных, запишем второе уравнение:
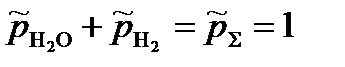
Решая систему уравнений получим:
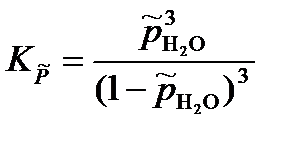
или
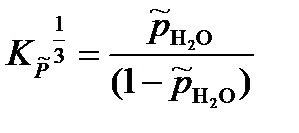
Откуда
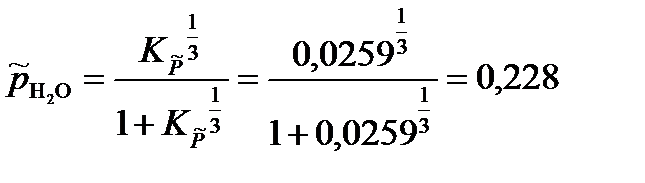
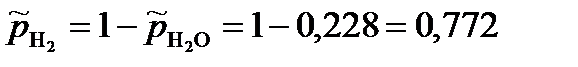
Парциальные давления газообразных веществ при нормальном атмосферном давлении равны:
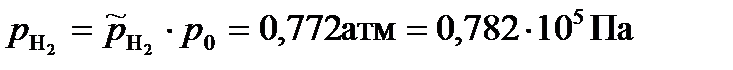
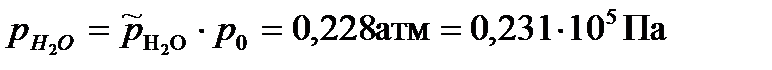
1.9 Многовариантное задание №1 «Расчет степени превращения, равновесного состава и выхода продукта химической реакции и выбор оптимальных условий проведения процесса»
Для выполнения этого задания предлагается следующий алгоритм:
1. На основании значений теплот образования веществ 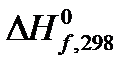 из «Краткого справочника физико-химических величин» [2] определите изобарный тепловой эффект химической реакции А (таблица 1.1) QP =
из «Краткого справочника физико-химических величин» [2] определите изобарный тепловой эффект химической реакции А (таблица 1.1) QP = 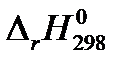 (в кДж) при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
(в кДж) при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
2. Определите изменение числа молей газообразных веществ реакции А при 298К и стандартном давлении.
3. Рассчитайте работу (в кДж), совершаемую в реакции А против внешнего давления при p = const и T = 298 K.
4. Определите изохорный тепловой эффект химической реакции А QV = 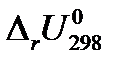 при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
при условии, что все вещества, участвующие в реакции, находятся в идеальном газообразном состоянии.
5. На основании данных из справочника [2] определите изменение средней теплоемкости в системе в результате реакции А 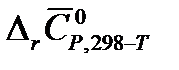 (в Дж/К). Температуру Т для своего варианта возьмите из таблицы 1.1.
(в Дж/К). Температуру Т для своего варианта возьмите из таблицы 1.1.
6. Определите тепловой эффект реакции А при температуре T и стандартном давлении 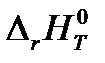 (в кДж), используя найденные ранее значения
(в кДж), используя найденные ранее значения 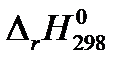 и
и 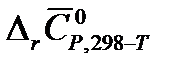 .
.
7. Установите, как будет меняться тепловой эффект химической реакции А при повышении температуры. Ответ аргументируйте, используя соответствующие уравнения химической термодинамики.
8. Определите изменение энтропии системы (в Дж/К) в результате химической реакции А (таблице 1.1), протекающей между веществами в идеальном газообразном состоянии при стандартном давлении и температуре 298 К. Значения стандартной энтропии для веществ возьмите из справочника [2].
9. Рассчитайте изменение энтропии 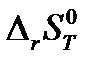 (в Дж/К) в результате реакции А при температуре Т и стандартном давлении, используя рассчитанные в п. 1.8. значения изменения энтропии при температуре 298 К и
(в Дж/К) в результате реакции А при температуре Т и стандартном давлении, используя рассчитанные в п. 1.8. значения изменения энтропии при температуре 298 К и 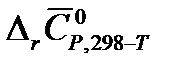 .
.
10. Определите изменение стандартной энергии Гиббса 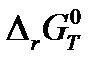 (Дж) для химической реакции А при температуре 298 К и при температуре Т.
(Дж) для химической реакции А при температуре 298 К и при температуре Т.
11. Рассчитайте термодинамическую константу равновесия Ka реакции А при температуре 298 К и температуре Т.
12. Определите глубину превращения ξ в реакции A при температуре Т и атмосферном давлении при условии, что исходные вещества взяты в стехиометрических количествах.
13. Определите глубину превращения ξ в реакции A при температуре Т и атмосферном давлении при условии, что исходные вещества взяты в количествах, указанных в таблице 1.2.
14. Определите степень превращения исходных веществ при условиях 12 и 13.
15. Определите состав равновесной смеси в %(мол.) для химической реакции А при температуре Т и атмосферном давлении при условиях 1.12 и 1.13.
16. Установите, как влияет повышение температуры на термодинамическую константу равновесия Ka и равновесный выход продуктов химической реакции А. Ответ аргументируйте, используя соответствующие уравнения химической термодинамики. Сопоставьте сделанные выводы с расчетными значениями констант равновесия.
17. Установите, как влияет повышение общего давления на равновесный выход продуктов химической реакции А. Ответ аргументируйте.
Таблица 1.1 – Варианты заданий
| Температура Т, К | |||||||
| Вариант | Химическая реакция А | Подвариант | |||||
| N2 + 3H2 = 2NH3 | |||||||
| CCl4 + 4H2 = CH4 + 4HCl | |||||||
| CH4 + 2S2 = CS2+ 2H2S | |||||||
| H2 + CCl4 = HCl + CHCl3 | |||||||
| CO + 3H2 = CH4 + H2O | |||||||
| Cl2 + CO = COCl2 | |||||||
| CH3I + HI = CH4 + I2 | |||||||
| CH4 + Br2 = CH3Br+ HBr | |||||||
| F2 + H2O = 2HF + O | |||||||
| CH4 + Cl2 = CH3Cl+ HCl | |||||||
| 2HBr = H2 + Br2 | |||||||
| 2HI = H2 + I2 | |||||||
| S2 + 2О2 = 2SO2 | |||||||
| CH3OH + H2 = CH4 + H2O | |||||||
| 2H2O = 2H2 + O2 | |||||||
| CH2 ––– CH2 + H2 = C2H5OH О | |||||||
| CO + H2O = CO2 + H2 | |||||||
| 3H2 + CO2 = CH3OH + H2O | |||||||
| 2N2O = 2N2 + O2 | |||||||
| N2 + O2 = 2NO | |||||||
| 2H2S = 2H2 + S2 | |||||||
| 2CH4 = C2H2 + 3H2 | |||||||
| CO + 2H2 = CH3OH | |||||||
| 2NO + O2 = 2NO2 | |||||||
| 2SO2 + O2 = 2SO3 | |||||||
| 2CO + 2H2 = CH4 + CO2 |
Таблица 1.2 – Варианты заданий
| Вариант | Начальное количество исходных веществ, моль | ||||
| N2 | – 0,2 | H2 | – 2,0 | ||
| CCl4 | – 5,0 | H2 | – 10,0 | ||
| CH4 | – 0,02 | S2 | – 0,1 | ||
| H2 | – 0,05 | CCl4 | – 1,0 | ||
| CO | – 0,02 | H2 | – 1,0 | ||
| Cl2 | – 0,5 | CO | – 5,0 | ||
| CH3I | – 0,3 | HI | – 3,0 | ||
| CH4 | – 0,2 | Br2 | – 2,0 | ||
| F2 | – 0,8 | H2O | – 4,0 | ||
| CH4 | – 1,0 | Cl2 | – 10,0 | ||
| HBr | – 0,2 | – | |||
| HI | – 0,3 | – | |||
| S2 | – 0,2 | O2 | – 2,0 | ||
| CH3OH | – 0,6 | H2 | – 6,0 | ||
| H2O | – 0,1 | – | |||
| СН3СНО | – 1,0 | H2 | – 10,0 | ||
| CO | – 0,3 | H2O | – 3,0 | ||
| H2 | – 0,1 | CO2 | – 1,0 | ||
| N2O | – 0,1 | – | |||
| N2 | – 1,0 | O2 | – 10,0 | ||
| H2S | – 1,0 | – | |||
| CH4 | – 0,1 | – | |||
| CO | – 0,1 | H2 | – 10,0 | ||
| NO | – 1,0 | O2 | – 5,0 | ||
| SO2 | – 0,2 | O2 | – 1,0 | ||
| CO | – 0,1 | H2 | – 1,0 |
1.10 Многовариантное задание №2 «Расчет равновесных парциальных давлений гетерогенной химической реакции»
1. Определите константу равновесия Ka химической реакции В при температуре T с использованием средних изобарных теплоемкостей.
2. Запишите в общем виде выражение для константы равновесия химической реакции B через парциальные давления реагирующих веществ.
3. Определите парциальные давления газообразных веществ при температуре T и атмосферном давлении.
4. Оцените влияние изменения общего давления, температуры и разбавления реакционной смеси газом, не участвующим в химической реакции, на положение равновесия реакции и равновесный выход продукта.
Таблица 1.3 – Варианты заданий
| Температура Т, К | |||||||
| Вар. | Химическая реакция B | Подвариант | |||||
| Fe + CO2 = FeO + CO | |||||||
| CO + H2 = C(графит) + H2O | |||||||
| Fe2O3 + 3CO = 2Fe + 3CO2 | |||||||
| C(графит) + CO2 = 2CO | |||||||
| Fe2O3 + H2 = 2FeO + H2O | |||||||
| FeO + H2 = Fe + H2O | |||||||
| Fe3O4 + H2 = 3FeO + H2O | |||||||
| Fe3O4 + 4H2 = 3Fe + 4H2O | |||||||
| Cr2O3 + 3CO = 2Cr + 3CO2 | |||||||
| 2ZnO + 2SO2= 2ZnS + 3O2 | |||||||
| Fe2O3 + 3H2 = 2Fe + 3H2O | |||||||
| 2SnS(α)+ 3O2 = 2SnO + 2SO2 | |||||||
| Mn3O4 + H2 = 3MnO + H2O | |||||||
| 2PbO(желт.) + 2SO2 = 2PbS + 3O2 | |||||||
| MnO2 + 2CO = Mn + 2CO2 | |||||||
| 3MnO + CO2 = Mn3O4 + CO | |||||||
| 3Fe2O3 + CO = 2Fe3O4 + CO2 | |||||||
| WO3 + 3H2 = W + 3H2O | |||||||
| Fe2O3 + CO = 2FeO + CO2 | |||||||
| CO2 = C(графит) + O2 | |||||||
| 2C(графит) + O2 = 2CO | |||||||
| Sb2O3 + 3H2 = 2Sb + 3H2O | |||||||
| CO + H2 = C(графит) + H2O | |||||||
| PbS + 2O2 = PbO2 + SO2 | |||||||
| PbO2 + CO = PbO(желт.) + CO2 | |||||||
| Mn2O3 + CO = 2MnO + CO2 |
1.11 Контрольные вопросы
1. По изменению каких термодинамических функций рассчитывается тепловой эффект химической реакции, протекающей в изобарных или изохорных условиях?
2. Как формулируется закон Гесса?
3. Какие следствия из закона Гесса Вы знаете?
4. Что называется стандартной теплотой образования вещества?
5. Как рассчитывается тепловой эффект реакции с использованием теплот образования?
6. Как рассчитывается тепловой эффект реакции с использованием теплот сгорания?
7. Что называется стандартной теплотой сгорания вещества?
8. Что такое истинная и средняя молярная изобарная теплоемкость?
9. Как формулируется закон Кирхгоффа в дифференциальной и интегральной форме?
10. Как зависит тепловой эффект химической реакции от температуры? Ответ подтвердите соответствующим уравнением.
11. Почему в справочниках приводятся абсолютные значения энтропии веществ, а абсолютные значения энтальпии – нет?
12. Какие критерии направления процессов в изолированных и закрытых системах Вы знаете?
13. Что является критерием равновесия в закрытых системах?
14. Что такое термодинамические и практические константы равновесия химических реакций? Приведите примеры.
15. С помощью какого уравнения рассчитываются термодинамические константы равновесия?
16. Что такое химическая переменная (глубина превращения в химической реакции)?
Как эта величина используется для расчета равновесного состава в химическом процессе?
17. Что такое степень превращения исходных веществ в химической реакции?
18. Как влияет температура на равновесный выход продукта химической реакции? Ответ подтвердите соответствующим уравнением.
19. Как влияет давление на равновесный выход продукта химической реакции? Ответ подтвердите соответствующим уравнением.
20. В чем особенность расчета равновесного состава газовой смеси в гетерогенной реакции?
ФАЗОВЫЕ РАВНОВЕСИЯ
Основными понятиями в теории фазовых равновесий являются: система, фаза, компоненты, термодинамические степени свободы, вариантность системы.
Фаза– совокупность однородных частей системы, отделенная от других частей системы границей (поверхностью) раздела и имеющая в каждой точке одинаковые химические и физические свойства. Фаза характеризуется уравнением состояния.
Гомогенная система– однородная система, состоящая из одной фазы.
Гетерогенная система– неоднородная система, состоящая из нескольких фаз.
Составляющие вещества– вещества, которые могут быть выделены из системы и вне нее могут устойчиво существовать.
Компоненты системы– составляющие вещества, наименьшее число которых достаточно для образования системы.
Если в системе не происходит химических взаимодействий, то число компонентов равно числу составляющих веществ. А если в системе происходит химическое взаимодействие, то число компонентов меньше числа составляющих веществ на число уравнений, связывающих концентрации этих веществ.
Термодинамические степени свободы– число параметров, определяющих состояние системы, которые можно менять произвольно и независимо друг от друга, не вызывая при этом изменения числа и природы фаз в системе. В качестве таких параметров, как правило, выбирают давление, температуру и концентрации.
Вариантность системы– число термодинамических степеней свободы.
Условием равновесия в системе в изобарно-изотермических условиях (при p = const и T = const) является выполнение следующих равенств:
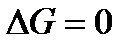
или
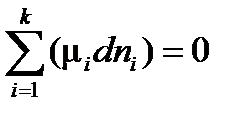 , ,
| (2.1) |
где k – число компонентов в системе.
Если в равновесии находятся две фазы
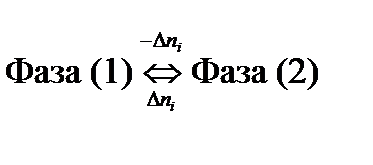 ,
,
то
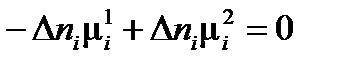 , ,
| (2.2) |
откуда
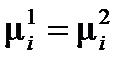 , ,
| (2.3) |
В многофазной гетерогенной системе условием равновесного существования фаз является равенство химических потенциалов для каждого i-го компонента во всех фазах:
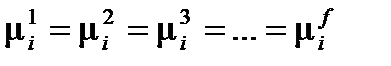 , ,
| (2.4) |
где f – число фаз в системе.
Правило фаз Гиббса, которое называют также основным законом фазовых равновесий, устанавливает связь между числом компонентов k, числом фаз f и числом термодинамических степеней свободы (вариантностью) s и выражается уравнением:
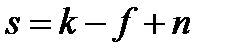 , ,
| (2.5) |
где n – число параметров (температура и давление), определяющих состояние системы.
Если, кроме концентраций, параметрами, определяющими состояние системы, являются только давление и температура, то n = 2. В частных случаях, когда один из параметров поддерживается неизменным, например, давление (в изобарных условиях) или температура (в изотермических условиях), n = 1. В изобарно-изотермических условиях (когда p = const и T = const) n = 0.
Если в равновесной системе число термодинамических степеней свободы s = 2, то она называется бивариантной. Это означает, что произвольным образом и независимо друг от друга, не вызывая изменения фазового состава системы можно менять два параметра состояния. Когда s = 1, система называется моновариантной и произвольным образом можно изменять только один параметр. При s = 0 ни один из параметров состояния не может изменяться, не вызывая изменения фазового состава. В этом случае систему называют нонвариантной или безвариантной.
Дата добавления: 2021-01-26; просмотров: 1309;











