Расчет термодинамических констант равновесия
Термодинамическая константа равновесия может быть выражена как через активности веществ, участвующих в реакции, Ka, так и через фугитивности Kf:
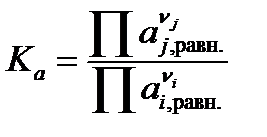
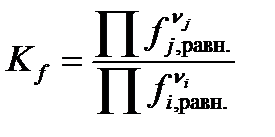 ,
,
Термодинамические константы равновесия являются безразмерными величинами.
Константа равновесия 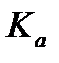 может быть рассчитана по частному уравнению изотермы химической реакции:
может быть рассчитана по частному уравнению изотермы химической реакции:
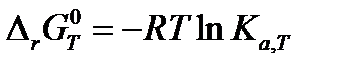 , ,
| (1.36) |
если известно значение изменения стандартной энергии Гиббса при данной температуре. Тогда термодинамическая константа равновесия 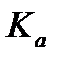 рассчитывается как экспонента:
рассчитывается как экспонента:
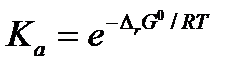 , ,
|
Термодинамическая константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от давления, поскольку изменение стандартной энергии Гиббса не зависит от давления по определению.
Величина константы равновесия может принимать значения от нуля до бесконечности: 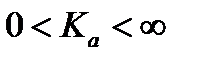
Пример: Рассчитаем термодинамическую константу равновесия реакции синтеза метанола при температурах 298 и 1000 К и давлении 101,325 кПа.
Решение: Рассчитаем изменение стандартной энергии Гиббса при температуре 298К, используя рассчитанные в предыдущих примерах значения 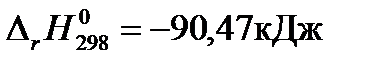 и
и 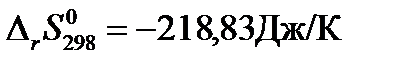 :
:
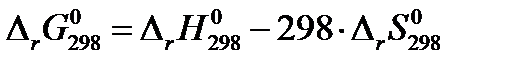 = – 90,47∙103 – 298∙( – 218,83) = – 25258,66 Дж
= – 90,47∙103 – 298∙( – 218,83) = – 25258,66 Дж
По частному уравнению изотермы химической реакции
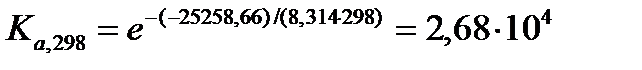
Для расчета константы равновесия при 1000 К воспользуемся рассчитанным в предыдущем примере значением стандартной энергии Гиббса при температуре 1000 К для реакции синтеза метанола 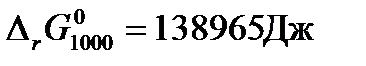 .
.
По частному уравнению изотермы химической реакции
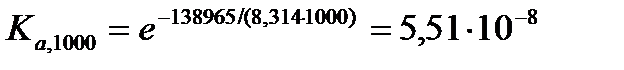
Если химическая реакция протекает при давлениях меньше ≤ 50 атм, то константа равновесия, выраженная через приведенные давления 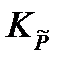 , равна термодинамической константе равновесия Ka и является безразмерной величиной.
, равна термодинамической константе равновесия Ka и является безразмерной величиной.
Дата добавления: 2021-01-26; просмотров: 879;











