Расчет степени превращения исходных веществ, выхода продукта и равновесного состава химической реакции
Для расчета равновесного состава была введена универсальная величина – химическая переменная или глубина превращения ξ (кси), равная отношению изменения количества вещества данного реагента или продукта реакции к его стехиометрическому коэффициенту в уравнении химической реакции:
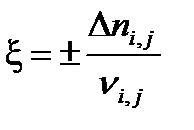 , ,
| (1.43) |
где знак “+” используется для продуктов реакции, а знак “ – “ для исходных веществ.
Равновесное количество вещества для каждого участника реакции выразим через глубину превращения:
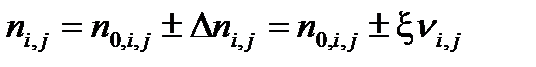
| (1.44) |
Подставив полученное выражение в уравнение, связывающее термодинамическую Ka = 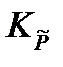 и практическую Kn константы равновесия, получим
и практическую Kn константы равновесия, получим
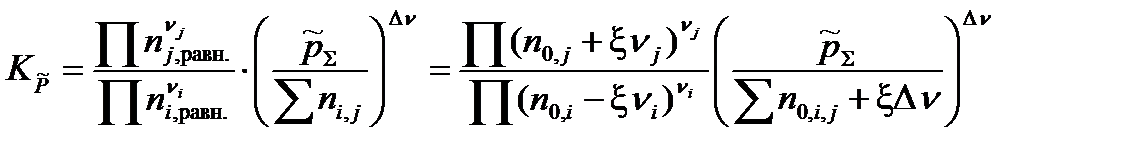
| (1.45) |
Решив это уравнение относительно химической переменной ξ, можно рассчитать: равновесные количества вещества каждого участника реакции, равновесные концентрации реагентов, степень превращения исходных веществ и выход продуктов реакции.
Пример: Определим равновесную глубину превращения ξ в реакции 2CO + S2 = 2COS при температуре 500 К и давлении 101,325 кПа, при условии, что исходные вещества взяты в стехиометрических количествах. Константа равновесия 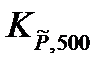 = 3,56·1011.
= 3,56·1011.
Решение: Выразим равновесный состав через химическую переменную ξ и найдем область допустимых значений (ОДЗ) ξ из условия, число молей вещества всегда положительная величина:
| 2CO | + S2 = | 2COS | |
исх. состав
n0,i  ,моль ,моль
| |||
равн. состав
n 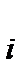 , моль , моль
|
2–2 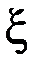
|
1– 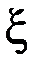
|
2 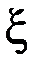
|
| ОДЗ ξ: | ||
2–2 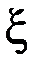 > 0 > 0
| ||
1– 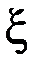 > 0 > 0
| => 0 < 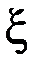 < 1 < 1
| |
2 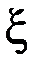 >0 >0
|
Выразим практическую константу Kn через глубину превращения ξ:
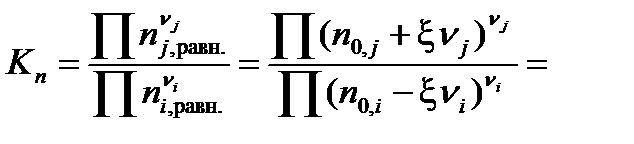
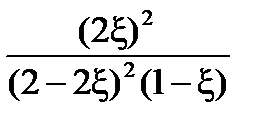
Выразим сумму молей газообразных веществ в равновесии через глубину превращения ξ:
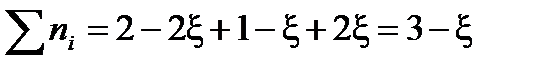
Найдем разность стехиометрических коэффициентов в уравнении реакции:
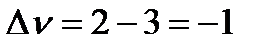
Подставим Kn, 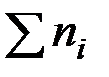 и
и 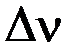 в уравнение, связывающее термодинамическую константу
в уравнение, связывающее термодинамическую константу 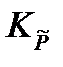 с практической константой Kn
с практической константой Kn
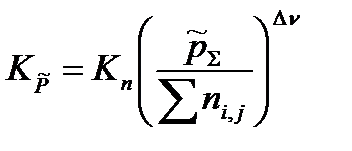
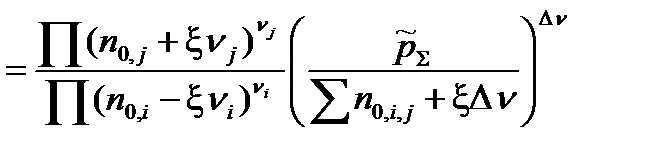 =
=
= 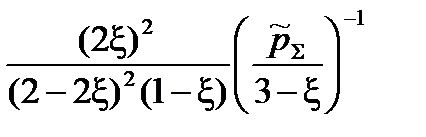 =
= 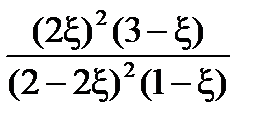
Полученное кубическое уравнение
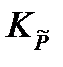 =
= 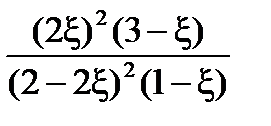
решаем точно, отбирая корни в соответствии с областью допустимых значений ξ, или приближенно (методом подбора или графически), что для практических расчетов вполне допустимо. Используя метод приближенных вычислений, получим при 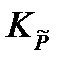 = 3,56·1011
= 3,56·1011 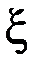 = 0,9998.
= 0,9998.
Пример: Определим равновесную глубину превращения ξ в реакции 2CO + S2 = 2COS при температуре 500 К и давлении 101,325 кПа, при условии, что исходный состав содержал 0,2 моля СО и 2 моля газообразной серы. Константа равновесия 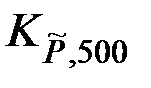 = 3,56·1011.
= 3,56·1011.
Решение: Выразим равновесный состав через химическую переменную ξ и найдем область допустимых значений (ОДЗ) ξ:
| 2CO | + S2 = | 2COS | |
исх. состав
n 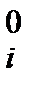 ,моль ,моль
| 0,2 | ||
равн. состав
n 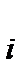 , моль , моль
|
0,2–2 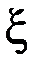
|
2– 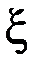
|
2 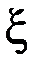
|
| ОДЗ ξ: | ||
0,2–2 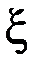 > 0 > 0
| ||
2– 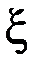 > 0 > 0
| => 0 < 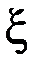 < 0,1 < 0,1
| |
2 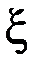 >0 >0
|
Выразим практическую константу Kn через глубину превращения ξ:
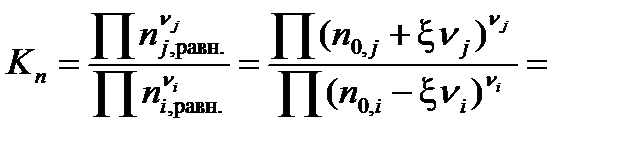
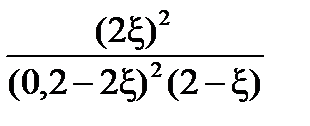
Выразим сумму молей газообразных веществ в равновесии через глубину превращения ξ:
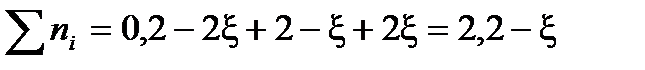
Найдем разность стехиометрических коэффициентов в уравнении реакции:
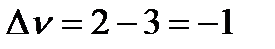
Подставим Kn, 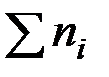 и
и 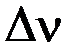 в уравнение, связывающее термодинамическую константу
в уравнение, связывающее термодинамическую константу 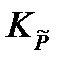 с практической константой Kn
с практической константой Kn
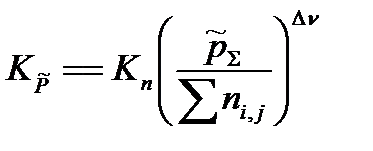
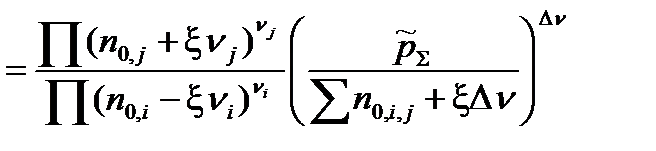 =
=
= 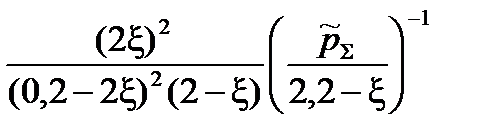 =
= 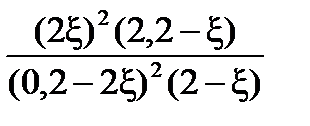
Полученное кубическое уравнение
 =
= 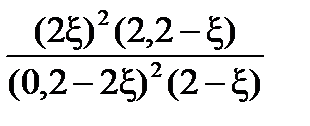
решаем приближенно и получаем при  = 3,56·1011
= 3,56·1011 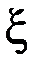 = 0,0999997.
= 0,0999997.
Пример: Определим степень превращения исходных веществ в реакции
2CO + S2 = 2COS
при условиях предыдущих примеров.
Решение:
Степень превращения βi – это отношение количества прореагировавшего вещества к его начальному количеству:
βi = 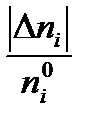 = = 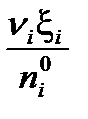
| ((1.46) |
При условии примера, в котором исходные вещества взяты в стехиометрических количествах, с 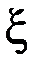 = 0,9998:
= 0,9998:
β 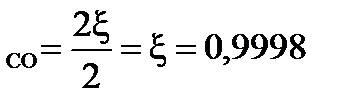 = 99,98 %
= 99,98 %
β 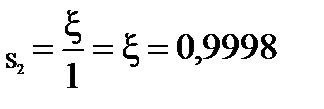 =99,98 %
=99,98 %
При условии примера, в котором исходный состав содержал 0,2 моля СО и 2 моля газообразной серы, с 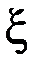 = 0,0999997
= 0,0999997
β 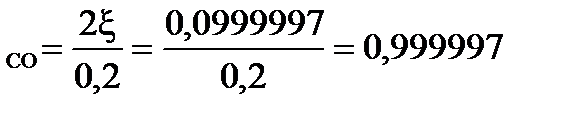 = 99,9997 %
= 99,9997 %
β 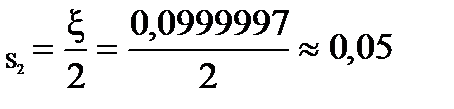 = 5,00 %
= 5,00 %
Пример: Определим состав равновесной смеси в % (мол.) для реакции
2CO + S2 = 2COS
при условиях предыдущих примеров.
Решение:
Мольная доля вещества в смеси равна:
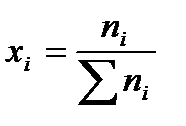
| ((1.47) |
или в % (мол):
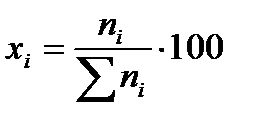
При условии примера, в котором исходные вещества взяты в стехиометрических количествах, с 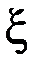 = 0,9998
= 0,9998
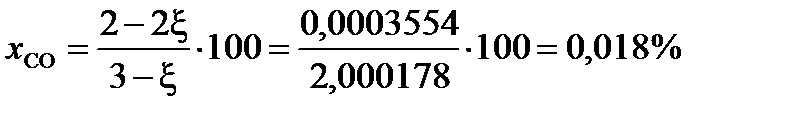 (мол.)
(мол.)
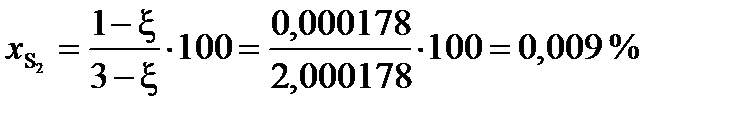 (мол.)
(мол.)
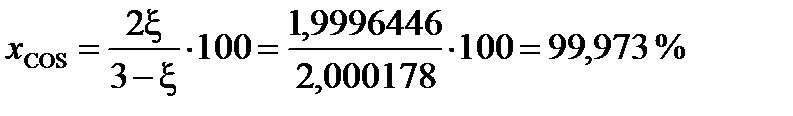 (мол.)
(мол.)
При условии примера, в котором исходный состав содержал 0,2 моля СО и 2 моля газообразной серы, с 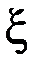 = 0,0999997
= 0,0999997
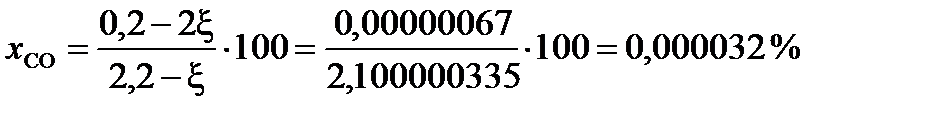 (мол.)
(мол.)
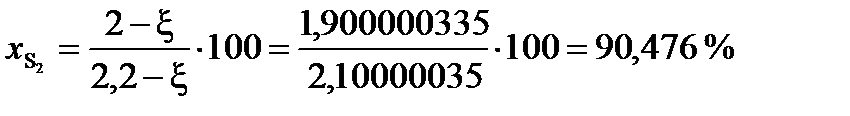 (мол.)
(мол.)
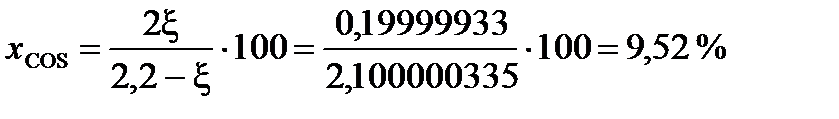 (мол.)
(мол.)
Дата добавления: 2021-01-26; просмотров: 881;











