СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Задача 1
Как изменится скорость прямой реакции (Т=const) 2SO2(г) + O2(г) ⇄ 2SO3(г) при увеличении общего давления в реакционном сосуде в три раза?
РЕШЕНИЕ. Из уравнения Клапейрона–Менделеева следует, что
p = n/V∙RT = CRT,
где С - концентрация в моль/л. Согласно закону действующих масс скорость прямой реакции до повышения давления 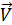 =
= 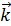 [SO2]2[O2]. После повышения давления в 3 раза концентрация всех газовых компонентов возрастет также в 3 раза, при этом константа скорости реакции останется неизменной, т.к. она не зависит от концентрации реагирующих веществ.
[SO2]2[O2]. После повышения давления в 3 раза концентрация всех газовых компонентов возрастет также в 3 раза, при этом константа скорости реакции останется неизменной, т.к. она не зависит от концентрации реагирующих веществ.
Уравнение скорости прямой реакции будет иметь следующий вид: 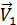 =
= 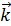 [3SO2]2[3O2] = 27
[3SO2]2[3O2] = 27 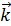 [SO2]2[O2]. Таким образом, скорость прямой реакции возрастет в 27 раз.
[SO2]2[O2]. Таким образом, скорость прямой реакции возрастет в 27 раз.
Задача 2 
Для реакции 2NO2(г) ⇄ 2NO(г) + O2(г) константа скорости прямой реакции при 600К равна 83,9 л/моль∙с, а при 645К она составляет 407л/моль∙с. Рассчитать энергию активации этого процесса.
РЕШЕНИЕ. Константа скорости реакции связана с энергией активации уравнением Аррениуса:
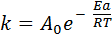 ,
,
в котором предэкспоненциальный множитель А0 и энергия активации Еа считаются независимыми от температуры. Перейдя к десятичным логарифмам и прологарифмировав уравнение, получим
lgk = 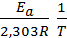 + lgA0.
+ lgA0.
Запишем это уравнение для двух температур
lgk1 = 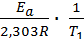 + lgA0 ; lgk2 =
+ lgA0 ; lgk2 = 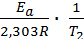 + lgA0 .
+ lgA0 .
Вычитая из второго уравнения первое и решая относительно энергии активации, получим
Ea = 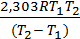 lg
lg 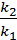
Подставляя численные значения величин в это уравнение, получим
Еа= 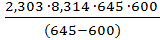 lg
lg 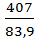 = 113,2 кДж/моль.
= 113,2 кДж/моль.
Задача 3
При 5000С равновесие реакции N2(г) + 3H2(г) ⇄ 2NH3(г) установилось при следующих концентрациях (моль/л) реагентов: [N2] = 1,8; [H2] = 7,4; [NH3] = 0,4. Определить: а) исходные концентрации азота и водорода; б) давление в реакционном сосуде в начальный момент и в момент наступления равновесия.
РЕШЕНИЕ. Обозначим исходные концентрации веществ как [N2]исх, [H2]исх. Часть исходных веществ, прореагировавших к моменту наступления равновесия обозначим как [N2]изр, [H2]изр, а равновесные концентрации - как [N2]равн, [H2]равн, [NH3]равн. В начальный момент времени в реакционной смеси присутствуют только азот и водород в начальных концентрациях. В процессе реакции их концентрации убывают, а концентрация аммиака увеличивается. После установления равновесия (когда скорости прямой и обратной реакций равны) в равновесной смеси присутствуют не успевшие прореагировать азот и водород и успевший образоваться аммиак, таким образом, равновесные концентрации исходных веществ будут равны разности между их исходными концентрациями и тем количеством, которое прореагировало к моменту равновесия:
[N2]равн = [N2]исх - [N2]изр; [H2]равн = [H2]исх - [H2]изр. Равновесные концентрации всех веществ даны в условии задачи, остается определить количества азота и водорода, прореагировавших к моменту равновесия. Из уравнения реакции следует, что на каждые 2 моля образовавшегося аммиака затрачивается 1 моль азота и три моля водорода. По условию задачи к моменту равновесия успело образоваться 0,4 моля аммиака. Для этого потребовалось:
из 3 молей [H2] образуется 2 моля [NH3], а
из Х молей [H2] образуется 0,4 моля [NH3],
откуда Х = 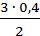 = 0,6 моля = [H2]изр.
= 0,6 моля = [H2]изр.
Аналогично находим, что к моменту равновесия израсходовалось
[N2]изр = 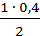 = 0,2 моля.
= 0,2 моля.
Рассчитаем исходные концентрации веществ:
[N2]исх = [N2]равн + [N2]изр = 1,8 + 0,2 = 2,0 моль/л;
[H2]исх = [H2]равн + [H2]изр = 7,4 + 0,6 = 8,0 моль/л.
Для решения этой задачи удобно составить схему:
N2(г) + 3H2(г) ⇄ 2 NH3 (г)
Сисх 2,0 8,0 0
Сизр 0,2 0,6 0
Сравн 1,8 7,4 0,4
С помощью этой схемы можно сделать любые расчеты, учитывая условия задачи.
б) согласно условию, Т = 500 + 273 = 773К, V= 1л.
Исходное число молей реагентов
νнач = νнач [N2] + νнач[H2] = 2 + 8 = 10 молей.
В состоянии равновесия число молей газов будет равно
νравн = νравн [H2] + νравн[N2] + νравн [NH3] = 7,4 + 1,8 + 0,4 = 9,6 моль.
Подставляя полученные значения в уравнение ( P = CRT) рассчитаем давление газовой смеси в начальный момент и в момент равновесия (R=8,31Дж/моль∙К=0,082 л∙атм/моль∙град).
Рнач = 10∙0,082∙773 = 633,86 атм,
Рравн = 9,6∙0,082∙773 = 608,5 атм.
Очевидно, что давление к моменту равновесия уменьшилось, так как реакция идет с убылью числа молей газов.
Задача 4
При 250С для реакции 1) SO2(г) + 1/2O2(г) ⇄ SO3(г) 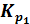 = 1,7∙1012. Рассчитать Кр и Кс при этой температуре для реакции 2) 2SO3(г) ⇄ 2SO2(г) + O2(г)
= 1,7∙1012. Рассчитать Кр и Кс при этой температуре для реакции 2) 2SO3(г) ⇄ 2SO2(г) + O2(г)
РЕШЕНИЕ. Согласно закону действующих масс для реакции 1) выражение константы химического равновесия будет иметь вид
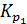 =
= 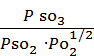 , а для реакции 2)
, а для реакции 2) 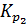 =
= 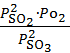 . Нетрудно установить, что между
. Нетрудно установить, что между 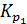 и
и 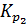 существует связь в виде
существует связь в виде 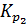 =
= 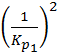 . Подставляя численные значения, получим:
. Подставляя численные значения, получим: 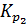 =
= 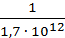 = 0,345∙10-24.
= 0,345∙10-24.
Известно, что а) Кр = Кс (RT) Dν , где Dν = åνпрод. - åνисх.веществ –изменение числа молей газообразных веществ в ходе реакции. Для реакции 2) Dν = (2+1) – 2 =1. Подставляя в ур.а) Т= 298К, R=0,082 л∙атм/моль∙К, получим
КС = 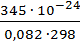 = 1,4∙10-26.
= 1,4∙10-26.
Задача 5
Для реакции CO(г) + Cl2(г) ⇄ COCl2(г) вычислить константу равновесия Кр, используя табличные значения термодинамических функций при стандартных условиях. По значению величины Кр ответить на вопрос: исходные вещества или продукты реакции преобладают в равновесной смеси?
РЕШЕНИЕ. Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением
DG0х.р = - 2,303RT lgKp. (1).
В свою очередь, DG0х.р. (химической реакции) можно рассчитать по изменению стандартных величин энтальпии и энтропии в ходе этой реакции:
DG0х.р = DН0х.р - ТDS0х.р ∙10-3. (2).
Значения DН0х.р и DS0х.р вычисляют по первому следствию из закона Гесса, используя табличные значения стандартных энтальпий образования и энтропий веществ
DН0х.р = å(DН0298)кон - å(DН0298)исх и DS0х.р = å(DS0298)кон - å(DS0298)исх.
Значения DН0298 и S0298 веществ, участвующих в реакции, приведены в таблице.
| Вещество | DН0298, кДж/моль | S0298, Дж/моль∙К |
| CO (г) | -110,6 | 197,7 |
| Cl2(г) | 222,9 | |
| COCl 2 (г) | -220,3 | 283,9 |
DН0х.р = DН0298 (COCl2) - DН0298(Cl2) - DН0298(CO) = -220,3 – 0 – (-110,6) = -109,7кДж,
DS0хр= S0298(COCl2) - S0298(Cl2) - S0298(CO) = 283,9 – 222,9 – 197,7 = -136,7 Дж/К,
DG0хр = -109,7 – 298 ∙(-136,7)∙10-3 = -69,3 кДж.
Из уравнения (1) следует
lgKp= 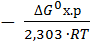 = -
= - 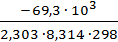 = 12,13 Кр= 1012,13, так как Кр>>1, то при Т=298К в равновесной смеси будут преобладать продукты реакции.
= 12,13 Кр= 1012,13, так как Кр>>1, то при Т=298К в равновесной смеси будут преобладать продукты реакции.
Задача 6
При некоторой температуре константа равновесия реакции H2(г) + I2(г) ⇄ 2HI(г) равна 50. Рассчитать равновесные концентрации веществ, если исходные концентрации водорода и йода были соответственно 0,6 и 0,8 моль/л.
РЕШЕНИЕ. Предположим, что к моменту равновесия прореагировало x молей водорода и, значит, х молей йода.
Тогда их равновесные концентрации будут
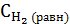 = 0,6 - х моль/л ,
= 0,6 - х моль/л , 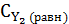 )= 0,8 - х моль/л,
)= 0,8 - х моль/л,
а равновесная концентрация йодистого водорода составит
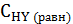 = 2х моль/л.
= 2х моль/л.
Выражение константы равновесия для этой реакции будет КС = 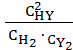 .
.
Подставляя в него соответствующие выражения, получим 50 = 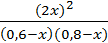 ,
,
откуда х2 - 1,52х + 0,52 = 0, х1,2 = 0,76 ± 0,24, х1 = 1, х2 = 0,52.
Первое значение не подходит по смыслу, т.к. уменьшение концентрации не может быть больше, чем исходные концентрации водорода и йода. Поэтому искомое значение х составляет 0,52моль/л. Следовательно, равновесные концентрации веществ будут равны: 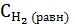 = 0,6 - 0,52 = 0,08 моль/л,
= 0,6 - 0,52 = 0,08 моль/л, 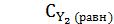 = 0,8 - 0,52 = 0,28 моль/л,
= 0,8 - 0,52 = 0,28 моль/л, 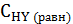 = 2∙0,52 = 1,04 моль/л.
= 2∙0,52 = 1,04 моль/л.
Задача 7
Для реакции CaCO3(тв) ⇄ CaO(тв) + CO2 (г) при 6000С и 7000С равновесные парциальные давления CO2 соответственно равны 0,0024 атм и 0,029 атм. Определить: 1) константы равновесия 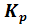 для данных температур; 2) тепловой эффект реакции при Р = const, считая его постоянным для интервала температур 600-7000С.
для данных температур; 2) тепловой эффект реакции при Р = const, считая его постоянным для интервала температур 600-7000С.
РЕШЕНИЕ. 1) реакция термического разложения карбоната кальция является гетерогенным процессом. Выражение константы равновесия будет 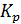 =
= 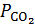 . Следовательно, при указанных температурах константы равновесия будут иметь следующие значения:
. Следовательно, при указанных температурах константы равновесия будут иметь следующие значения: 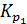 = 0,0024 и
= 0,0024 и 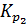 = 0,029.
= 0,029.
2) Тепловой эффект при Р,Т = const равен изменению энтальпии химической реакции DН0х.р. Для расчета DН0х.р можно воспользоваться следующим уравнением:
DН0х.р = 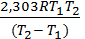 lg
lg 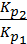 =
= 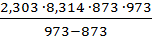 lg
lg 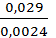 = 176,65 кДж.
= 176,65 кДж.
РАСТВОРЫ
Дата добавления: 2021-01-26; просмотров: 561;











