ПРИМЕР 2. Могут ли в стандартных условиях одновременно находиться в растворе хлориды двухвалентного олова и трехвалентного железа?
РЕШЕНИЕ. Представим данную систему в виде реакции
SnCl2 + FeCl3 = SnCl4 + FeCl2
Определим по таблице значения стандартных электродных потенциалов полуреакций.
Sn2+ - 2  = Sn4+ Е0восс = +0,151 В
= Sn4+ Е0восс = +0,151 В
2 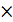 Fe3+ +
Fe3+ +  = Fe2+ Е0ок = +0,771 В.
= Fe2+ Е0ок = +0,771 В.
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
В данном примере Еок > Eвосс, т.е. реакция в стандартных условиях будет протекать самопроизвольно в прямом направлении и, следовательно, указанные хлориды будут реагировать между собой, поэтому одновременное нахождение их в растворе невозможно.
ПРИМЕР 3. Рассчитать константу равновесия окислительно-восстановительной системы при стандартных условиях:
10Br- + 2MnO4- + 16H+ = 5Br2 + 2Mn2+ + 8H2O,
если E0(Br2/Br-) = 1,065В; E0(MnO4-/Mn2+) = 1,507В.
РЕШЕНИЕ. Представим данную реакцию в виде полурекций окисления и восстановления:
2Br- -2ē = 5Br2 Е0восс = 1,065 В,
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O, E0окис = 1,507В.
Константа равновесия К окислительно-восстановительной реакции с окислительно-восстановительными потенциалами связана следующим соотношением:
lgК= 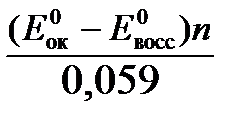 .
.
Окислителем в данной реакции является MnO4-, а восстановителем – Br-. В окислительно-восстановительном процессе участвуют 10 электронов.
Отсюда:
lgK = 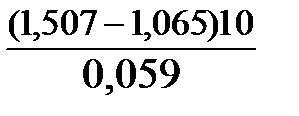 = 76,27,
= 76,27,
K =1,66.1076,27.
ПРИМЕР 4. Рассчитайте равновесный потенциал электрода, на котором протекает реакция PbO2 + 4 H+ + 2ē ↔ Pb2+ + 2H2О, если 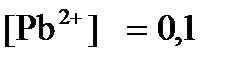 моль/л, а рН=5.
моль/л, а рН=5.
РЕШЕНИЕ. Потенциал окислительно-восстановительного электрода определяем по уравнению:
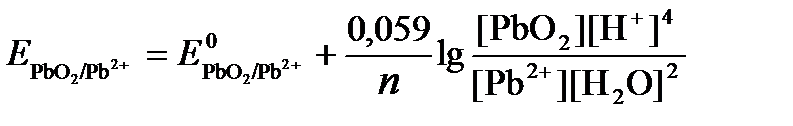 .
.
Активность 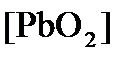 (как твердого вещества) и
(как твердого вещества) и 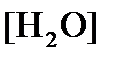 принимаются постоянными и включены в
принимаются постоянными и включены в 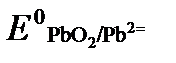 =+1,449 В, n = 2 –число электронов. С учетом этого,
=+1,449 В, n = 2 –число электронов. С учетом этого,
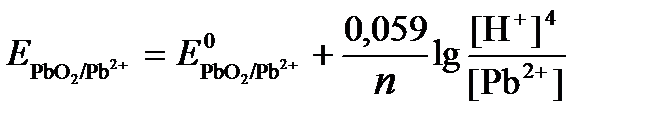
Исходя из того, что рН =-lg[H+] или [H+]= 10-рН , уравнение принимает вид
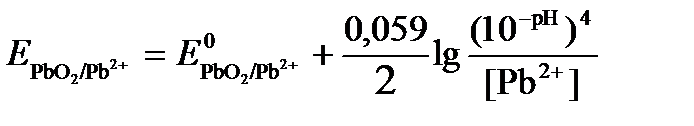 .
.
Подставляя значения Е0 и концентраций ионов, получаем
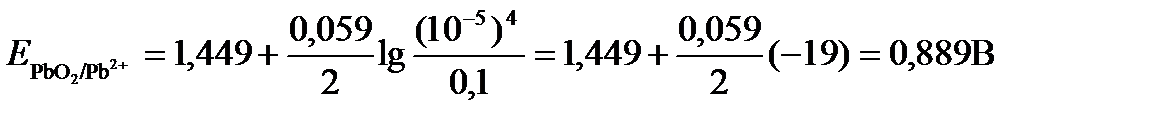 .
.
Дата добавления: 2021-01-26; просмотров: 715;











