ПРИМЕР 5. Рассчитайте ЭДС окислительно-восстановительной системы
3Fe2+ + NO3- + 4H+ = NO + 3Fe3+ + 2H2O,
если [Fe2+]=10-3 моль/л, [Fe3+]=10-2 моль/л, [NO32+]=10-1 моль/л, а рН=3.
РЕШЕНИЕ. Выразим данную ОВ-систему в виде окислительно-восстановительных полурекций с указанием стандартных ОВ-потенциалов:
а) Fe2+ - ē →Fe3+  +0,771 В,
+0,771 В,
б) NO3- + 4H+ + 3ē → NO + 2H2O 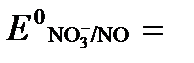 +0,960 В.
+0,960 В.
Для реакции (а) определим ОВ-потенциал по уравнению (3):

Для реакции (б) используем уравнение Нернста с учетом рН-среды:
 .
.
Имея ввиду, что активности [NO] и [H2O] являются постоянными и
включены в значение Е0, а [H+]=10-рН,рассчитаем ОВ-потенциал реакции (б) по уравнению:
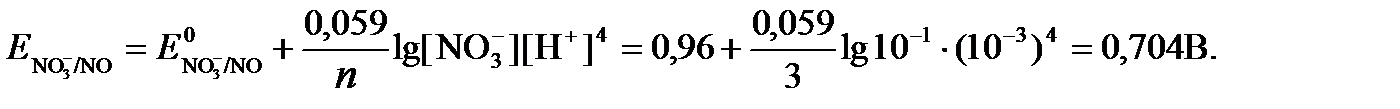
Затем рассчитаем ЭДС приведенной окислительно-восстановительной системы:
ЭДС= ΔЕ =Еокс – Евосст=  ,
,
Так как ΔЕ <0, следовательно, реакция в прямом направлении протекать не может.
ПРИМЕР 6. Могут ли в стандартных условиях KClO3 и КBr одновременно находиться в щелочном растворе? Если нет, то укажите возможные продукты окисления и восстановления.
РЕШЕНИЕ. В бромиде калия КBr бром имеет низшую степень окисления -1 (Br-1), следовательно, он может проявлять только восстановительные свойства. В щелочной среде возможны следующие реакции окисления Br-1:
а) Br-1 + 6ОН- - 6ē = BrО3-1 + 3Н2О Е0 = +0,61В
б) Br-1 + 2ОН- - 2ē = BrО-1 + Н2О Е0 = +0,76В.
В ионе ClO3- хлор находится в промежуточной степени окисления +5. В случае совместного нахождения в растворе с восстановителем (КBr), KClO3 будет проявлять только окислительные свойства.
В щелочном растворе возможно восстановления ClO3- по реакции:
ClO3- + 3Н2О +6е = Cl- + 6ОН- Е0 = +0,63В.
Сравнивая потенциалы окислителя и восстановителя, можно сделать вывод, что реакция окисления Br-1 по реакции (б) не может протекать, потому, что Еок < Eвосс. Окисление же Br-1 в присутствии KClO3 по реакция (а) возможно:
Br-1 + 6ОН- - 6ē = BrО3-1 + 3Н2О
+ ClO3- + 3Н2О +6ē = Cl- + 6ОН-
Br-1 + 6ОН- + ClO3- + 3Н2О = BrО3-1 + 3Н2О + Cl- + 6ОН-
KClO3 + КBr = КBrО3+ КCl
Таким образом, KClO3 и КBr одновременно находится в щелочном растворе не могут, а вероятные продукты реакции - KCl и К BrО3.
ПРИМЕР 7. Может ли пероксид водорода H2O2 проявлять окислительные и восстановительные свойства? На основании стандартных электродных потенциалов привести примеры возможных реакций.
РЕШЕНИЕ. Пероксид водорода H2O2 , имеет в своем составе кислород в промежуточной степени окисления (-1), поэтому он может проявлять как окислительные, так и восстановительные свойства.
Например, в кислой среде восстановление H2O2 протекает по реакции:
H2O2 + 2H+ + 2ē = 2H2O E0 =1,776 B.
Окисление H2O2 протекает по реакции:
H2O2 -2ē = О2 + 2Н+ E0 =0,682 B.
Чтобы в ОВ-реакции H2O2 проявлял окислительные свойства, надо по окислительно-восстановительным потенциалам выбрать восстановитель, у которого потенциал был меньше 1,776 В. Например, ион I- для которого:
2 I-1 - 2ē = I2 Е0 = +0,536В.
Таким образом,
H2O2 + 2H+ + 2ē = 2H2O
2 I-1 - 2ē = I2
H2O2 + 2H+ + 2 I-1 = I2 + 2H2O.
Чтобы в ОВ-реакции H2O2 проявлял восстановительные свойства, надо по окислительно-восстановительным потенциалам выбрать окислитель, у которого потенциал был больше 0,682 В, например ион ClO3-, для которого
2ClO3- + 12H+ + 10е = Cl2 + 6 H2O Е0 = +1,47В.
Таким образом,
H2O2 -2ē = О2 + 2Н+ ×5
+ 2ClO3- + 12H+ + 10ē = Cl2 + 6 H2O
5H2O2 -2ClO3- + 12H+ = 5О2 + 10Н+ + Cl2 + 6 H2O.
Сократив в правой части ионы водорода (Н+), получаем:
5H2O2 -2ClO3- + 2H+ = 5О2 + Cl2 + 6 H2O.
Дата добавления: 2021-01-26; просмотров: 581;











