ОСНОВЫ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ
ЗАДАЧА 1. Произойдет или нет изменение массы железной пластины при ее опускании в растворы: а)ZnCl2; б)Ag NO3; в) HCl.
РЕШЕНИЕ. Предполагаемыми окислителями в этих растворах могут выступать ионы Zn2+, Ag+, H+. Атомы железа во всех трех случаях должны выступать в качестве восстановителя. Из термодинамики следует, что окислительно-восстановительная реакция может протекать самопроизвольно, если потенциал окислителя будет больше, чем потенциал восстановителя. Сравним потенциалы полуреакций.
Zn2+ + 2ē = Zn0 E0 = -0,763 B
Ag+ + ē = Ag0 E0 = +0,799 B
H+ + ē = H0 E0 = 0,0 B
Fe - 2ē = Fe2+ E0 = -0,44 B
Видно, что железо может быть окислено только ионами серебра и водорода, так как их потенциалы более положительны.
Fe + Ag+ = Fe2+ + Ag0
На 1 моль растворившегося железа на пластинке осядет 1 моль металлического серебра. Сравнив их молярные массы МFe = 55,8 г/моль и МAg =107,9 г/моль, определим, что масса железной пластины увеличится.
В растворе соляной кислоты железная пластина будет растворяться, а образовавшийся газообразный водород будет удаляться из раствора:
Fe + 2Н+ = Fe2+ + Н20.
Масса железной пластины будет уменьшаться.
В растворе хлористого цинка реакции не будет, поэтому масса пластины не изменится.
ЗАДАЧА 2. Рассчитайте ЭДС медно-цинкового гальванического элемента а) в стандартных условиях;
б)если концентрации ионов составят [Zn2+] = 10-2моль/л, а [Cu2+] = 2 моль/л.
РЕШЕНИЕ. Токообразующая реакция гальванического элемента:
Zn0 + Cu2+ = Zn2+ + Cu0
На аноде (-) будет происходить окисление металлического цинка а на катоде (+) – восстановление ионов меди из электролита.
А) схема гальванического элемента может быть записана следующим образом:
(-)Zn│ Zn2+ ││ Cu2+ │Cu (+)
Для расчета ЭДС (ΔЕ0) в стандартных условиях воспользуемся стандартными электродными потенциалами
ΔЕ0 = Е0окисл. - Е0восстан.= Е0Cu - Е0Zn = +0,337 – (-0,763) = 1,1В.
Б) если концентрация ионов металла в растворах отличается от 1моль/л, то для расчета ЭДС необходимо вначале рассчитать потенциалы электродов. Для этого воспользуемся уравнением Нерста.
Е = Е0 + 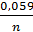 lg [Me+n]
lg [Me+n]
ЕСu = +0,337 + 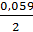 lg [2] =+0,346В ,
lg [2] =+0,346В ,
ЕZn = - 0,763 + 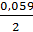 lg [10-2] = - 0,822В
lg [10-2] = - 0,822В
Рассчитаем ЭДС элемента
ΔЕ = Еокисл. - Евосстан.= ЕCu - ЕZn = 0,346 – (-0,822) = 1,168В.
Отметим, что по сравнению со стандартными условиями ЭДС гальванического элемента возросла.
ПРИМЕР 3. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида кадмия CdCl2
а) с инертным анодом;
Дата добавления: 2021-01-26; просмотров: 533;











