Б) с кадмиевым анодом.
РЕШЕНИЕ.
а) в растворе хлорида кадмия CdCl2 в электродных процессах могут участвовать ионы натрия Cd2+, Cl- и молекулы воды. Угольные электроды относятся к инертным и окислению не подвергаются. На катоде возможны следующие реакции:
Cd2+ + 2e → Cd E0= -0,403B
2H2O + 2e → H2 + 2 OH- Е0 = -0,82 В (при рН = 14)
Потенциал восстановления молекул воды(-0,82В) приведен для щелочного раствора с учетом подщелачивания среды в ходе электролиза. Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов кадмия.
Большинство процессов при электролизе идет с перенапряжением, особенно образование газов (H2, O2 и др.). Пренебрежение величиной перенапряжения полуреакций может привести к неправильному определению природы электродного процесса.
Возможные анодные реакции:
2 Cl- - 2 e → Cl2 Е0 = +1,36В
2H2O – 4 e  O2 + 4 H+ Е0 = +1,23В (рН = 0)
O2 + 4 H+ Е0 = +1,23В (рН = 0)
Потенциал окисления воды дан для кислого раствора (рН =0), с учетом подкисления раствора при электролизе.
Согласно величинам стандартных электродных потенциалов на аноде должен выделяться кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение реакции выделения кислорода η0 = 1,17 В, что повышает потенциал окисления воды до 2,4 В.
Для получения суммарной реакции электролиза складываем катодную и анодную реакции. Электролиз раствора хлорида кадмия протекает с образованием металлического кадмия на катоде и газообразного хлора на аноде:
Cd2+ + 2Cl- = Cd + Cl2.
б) кадмиевый анод является окисляемым (растворимым) и может участвовать в электродных реакциях.
К двум выше описанным анодным реакциям добавляется реакция окисления кадмия
2 Cl- - 2 e → Cl2 Е0 = +1,36В
2H2O – 4 e  O2 + 4 H+ Е0 = +1,23В (рН = 0)
O2 + 4 H+ Е0 = +1,23В (рН = 0)
Cd0 - 2e → Cd2+ Е0 = - 0,403 В
Наиболее отрицательный потенциал у третьей реакции, и анодное выделение хлора заменяется анодным растворением кадмиевого анода.
Суммарная реакция также меняется:
Cd2+ + Cd0 = Cd0 + Cd2+.
Подобная запись означает, что сколько кадмия растворилось на аноде ровно столько же кадмия восстановилось на катоде.
ПРИМЕР 4. Электролиз водного раствора сульфата меди CuSO4 с нерастворимым анодом протекал в течениеt=5 часов при силе токаI= 10 А. Рассчитайте массу меди, осевшей на катоде при выходе по токуBт = 90%, и объем газа, выделившегося на аноде с выходом по токуBт = 95%.
РЕШЕНИЕ. Вначале необходимо определить электродные реакции. Из условия задачи следует, что на катоде идет реакция восстановления ионов меди:
Cu2+ + 2 e = Cu0 Е0= + 0,337 В.
На аноде возможны две конкурирующие реакции
2 SO42- - 2e → S2O82- Е0 = +2,05В,
2 H2O - 4 e → 4H+ + O2 Е0 = +1,23В.
Так как потенциал реакции окисления воды значительно меньше, то на аноде пойдет именно эта реакция.
Суммарная реакция электролиза
2Cu2+ + 2 H2O = 2Cu0 + 4H+ + O2
2CuSO4 + 2 H2O = 2Cu0 + 2H2SO4 + O2
На катоде осаждается металлическая медь, на аноде выделяется газообразный кислород, а в прианодном пространстве происходит подкисление электролита за счет образования серной кислоты (понижение рН раствора).
По первому закону Фарадея масса вещества, образующегося при электролизе, прямо пропорциональна количеству пропущенного через раствор электричества (Q = I t):
m = 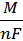 I t Bт,
I t Bт,
М = 63,5 г/моль - молярная масса меди, n – число электронов в полуреакции катодного восстановления меди; F = 26,8 А∙час/моль - число Фарадея.
Подставим цифры и сделаем расчет:
MCu =  ∙10∙5∙0,9 = 53,31г.
∙10∙5∙0,9 = 53,31г.
Для расчета объема образовавшегося в анодной реакции кислорода воспользуемся уравнением Фарадея другого вида:
V = 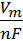 I t Вт,
I t Вт,
где Vm (л/моль) – молярный объем – 22,4 л/моль.
VO2 = 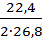 10∙5∙0,95 = 19,85л.
10∙5∙0,95 = 19,85л.
Дата добавления: 2021-01-26; просмотров: 1109;











