Примеры решения задач
Задача 1. Определите молярность, нормальность и мольную долю 16,08% раствора H2SO4 (r =1,1 г/см3).
РЕШЕНИЕ. Молярная концентрация (молярность) определяется по формуле 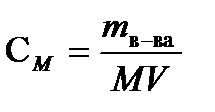 , где m=16,08г - масса H2SO4, содержащаяся в 100г раствора (из определения массовой доли).
, где m=16,08г - масса H2SO4, содержащаяся в 100г раствора (из определения массовой доли).
Объем 100г р-ра V =  =
= 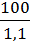 » 0,091л.
» 0,091л.
Следовательно, Cм = 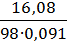 =1,8 моль/л
=1,8 моль/л  .
.
Нормальность рассчитывается по формуле Сн = 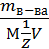 , Z = 2
, Z = 2
(кислота двухосновная), таким образом. Сн = 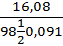 = 3,6 моль/л.
= 3,6 моль/л.
Зная молярную концентрацию и фактор эквивалентности fэкв= 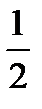 , нормальную концентрацию можно рассчитать и по формуле
, нормальную концентрацию можно рассчитать и по формуле
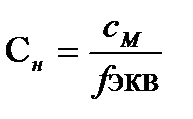 =
= 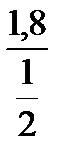 = 3,6 моль/л.
= 3,6 моль/л.
Мольная доля определяется по формуле
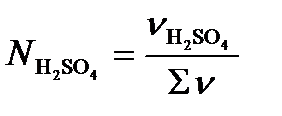 .
. 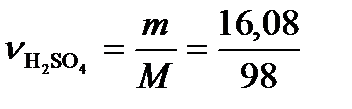 = =0,164моль. Масса воды
= =0,164моль. Масса воды 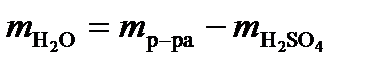 =
=
= 100 – 16,08 = 83,92 г. 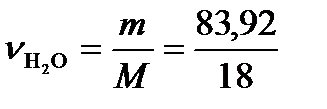 =4,662 моль.
=4,662 моль.
Таким образом, 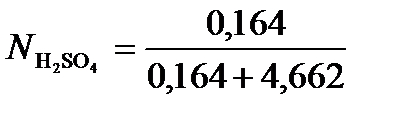 =0,034.
=0,034.
Задача 2. Сколько миллилитров 60% раствора СН3СООН (r =1,07 г/см3) потребуется для приготовления 200 мл 0,1М раствора.
РЕШЕНИЕ. Масса уксусной кислоты в 200 мл (0,2л) 0,1М раствора СН3СООН рассчитывается по формуле m = CMMV = 0,1моль/л∙60г/моль∙0,2л =1,2г (М = 60 г/моль). Масса 60% раствора, в котором содержится
1,2г СН3СООН, определяется из формулы, ω,% = 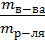 100%.
100%.
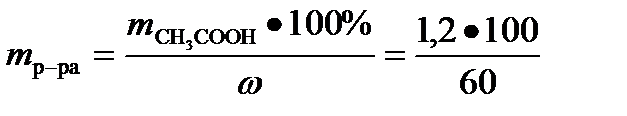 = 2г. Таким образом, необходимый объем 60% раствора кислоты V=
= 2г. Таким образом, необходимый объем 60% раствора кислоты V=  =
= 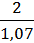 = 1,87см3=1,87мл.
= 1,87см3=1,87мл.
Задача 3. В каком соотношении надо смешать растворы 12% и 3% азотной кислоты для получения 10% раствора?
РЕШЕНИЕ. Для решения задачи воспользуемся правилом креста.
12 10 - 3 = 7
10
3 12 - 10 = 2
Значит, для получения 10% раствора азотной кислоты необходимо смешать 7 частей (масс) 12% раствора и 2 части (массы) 3%.
Задача 4. Рассчитать концентрацию ионов водорода в растворе HCN (См = 10-3 М ), если a= 4,2∙10-3.
РЕШЕНИЕ.Диссоциация цианистоводородной кислоты протекает по уравнению HCN ↔ H+ + CN-; концентрации ионов [H+] и [CN-] в растворе равны между собой ( так как nН+ : nСN- = 1:1, где n- стехиометрические коэффициенты) т.е. [H+] = [CN-] = aCм, моль/л; Тогда [H+] = [CN-] = 4,2∙10-3∙ 10-3 = 4,2×10-7 моль/л.
Задача 5.Рассчитать концентрацию ионов водорода и гидроксид-ионов в рстворе NH4OH, концентрацией См= 0,01М, если Кд= 1,8×10-5.
РЕШЕНИЕ.: Гидроксид аммония диссоциирует следующим образом:
NH4OH ↔ NH4+ + OH-, константа диссоциации имеет вид
Кд= 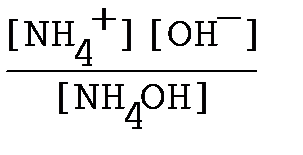 ;
;
концентрации ионов аммония [NН4+] и гидроксида [OH-] совпадают
(n(NH4+) :n(OH-) = 1:1), обозначим их за х:
[NH4+] = [OH-] = х моль/л, тогда выражение для Кд примет вид
1,8×10-5 = х2/ 0,01-х. Считая, что х << См, решаем уравнение
1,8×10-5=x2/ 0,01, относительно х:
х = 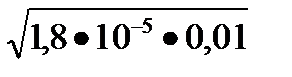 =4,2∙10-4моль/л; [OH-]= 4,2∙10-4 моль/л.
=4,2∙10-4моль/л; [OH-]= 4,2∙10-4 моль/л.
Концентрации ионов водорода и гидроксида связаны через ионное произведение воды Кw= [H+][OH-] =10-14, выразим концентрацию ионов водорода [H+] = Kw/[OH-] и рассчитаем её значение:
[H+]=1×10-14/4,2×10-4 = 2,3×10-11моль/л.
Задача 6. Определить рН раствора НСl (a=1), если См =2∙10-3 М.
РЕШЕНИЕ.Диссоциация соляной кислоты протекает по уравнению
HCl ® H+ + Cl-, концентрация ионов водорода [H+] = a Cм =1∙2∙10-3 = =2∙10-3 моль/л. Водородный показатель рН = - lg[H+] = - lg2∙10-3 = 2,7.
Задача 7. Определить молярную концентрацию гидроксида аммония, если рН=11, а Кд=1,8∙10-5.
РЕШЕНИЕ. Концентрация ионов водорода [H+]=10-pH=10-11моль/л. Из ионного произведения воды определяем концентрацию [OH-]
[OH-] = Kw / [H+]=10-14/10-11 =10-3моль/л.
Гидроксид аммония - слабое основание и характеризуется уравнением реакции диссоциации NH4OH ↔ NH4+ + OH-. Выражение для константы диссоциации
Кд = 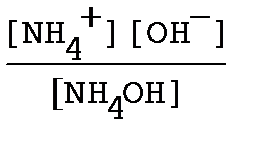
из закона Оствальда следует, что [NH4+ ] = [OH-] = a∙Cм, а Кд= a2См. Объединяя уравнения, получим См=[OH-]2/Kд = 10-6/ 1.8∙10-5 = 0,056 моль/л.
Задача 8. Концентрация насыщенного раствора (См) Mg(OH)2 равна 1,1•10-4 моль/л. Записать выражение для ПРи вычислить его величину.
РЕШЕНИЕ.В насыщенном растворе Mg(OH)2 устанавливается равновесие между осадком и раствором Mg(OH)2 ↔ Mg2++2OH-, для которого выражение ПР имеет вид ПР= [Mg2+][OH-]2. 158
Зная концентрации ионов, можно найти его численное значение. Учитывая полную диссоциацию Mg(OH)2, концентрация егонасыщенного раствора
См= [Mg2+]= 1,1×10-4 моль/л, а [OH-] = 2[Mg2+] = 2,2×10-4 моль/л. Следовательно, ПР= [Mg2+][OH-]2 =1,1. 10-4× (2,2 10-4)2 = 5,3. 10-12.
Задача 9.Вычислить концентрацию насыщенного раствора и ПР хромата серебра, если в 0,5 л воды растворяется 0,011 г соли.
РЕШЕНИЕ.Для определения молярной концентрации насыщенного раствора Ag2CrO4 воспользуемся формулой 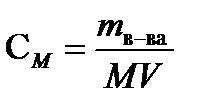 , где m- масса растворенного вещества (г), М- молярная масса ( г/моль), V - объем раствора (л). М(Ag2CrO4) =332 г/моль. См =
, где m- масса растворенного вещества (г), М- молярная масса ( г/моль), V - объем раствора (л). М(Ag2CrO4) =332 г/моль. См = 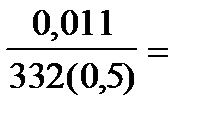 9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли:
9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли:
Ag2CrO4 ↔ 2Ag++ CrO42-
ПР=[Ag+]2[CrO42-],
где [CrO42-] = См = 9,48.10-5 моль/л, а [Ag+] = 2 См =1,896× 10-4 моль/л . Таким образом, ПР = (1,896× 10-4)2 (9,48 ×10-5) = 3,4 ×10-12.
Задача 10. Можно ли приготовить растворы соли СаСО3 с концентрациями СаСО3 С1 =10-2 М и С2 = 10-6 М , если ПР СаСО3 = 3,8× 10-9.
РЕШЕНИЕ.Зная величину ПР, можно рассчитать концентрацию насыщенного раствора соли и, сравнив ее с предлагаемыми концентрациями, сделать вывод о возможности или невозможности приготовления растворов. Растворение карбоната кальция протекает по схеме CaCO3 ↔ Ca2+ +CO32- В данном уравнении n = m = 1, тогда
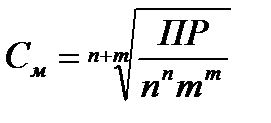 =
= 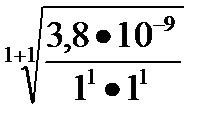 ≈ 6,2•10-5моль/л ,
≈ 6,2•10-5моль/л ,
С1> См – раствор приготовить нельзя, так как будет выпадать осадок;
С2< См – раствор приготовить можно.
Дата добавления: 2021-01-26; просмотров: 776;











