Какой из факторов (энтальпийный или энтропийный) определяют направление самопроизвольного протекания реакции при низких и высоких температурах?
РЕШЕНИЕ. Изменение энтальпии реакции образования пероксида бария имеют ∆Н°хр = 2∆Н°ВаО2 - (2∆Н°ВаО + ∆Н°О2) = -634,7∙2 - (-553,9∙2 + 0) = -161,6 кДж.
Изменение энтропии
∆S°хр =2S°ВаО2 – (2S°ВаО + S°О2) =77,5∙2 – (70,5∙2 + 206) = -191 Дж/К = - 0,191 кДж/К.
Свободная энергия этого процесса выразится уравнением ∆G°хр = ∆Н°хр- Т∆S°хр. При стандартных условиях ∆G°хр = -161,6 + 0,191× 298 = -104,68 кДж. Так как ∆G°хр < 0, реакция при стандартных условиях протекать может.
Температуру инверсии можно найти из соотношения ∆G° = 0. Отсюда следует:
∆G°хр = ∆Н°хр- Т∆S°хр = 0, а Тинв = 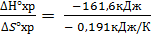 = 846,07 К.
= 846,07 К.
Выше температуры 846,07 К процесс образования BaO2 не может быть реализован.
Из расчетов следует, что ∆Н°хр< 0 и ∆S°хр< 0. При Т < 846,07К ∆G°хр < 0 и, значит, знак ∆G°хр определяется энтальпийным фактором (∆Н°хр< 0). При Т > 846,07К ∆G°хр меняет свой знак на положительный и определяющим становится энтропийный фактор.
Задача 4.
Вычислить изменение энтропии при испарении 250 г воды при 25 °С, если мольная теплота испарения воды (∆Н°исп) при этой температуре равна 44,08 кДж/моль.
РЕШЕНИЕ. Процессы фазовых переходов происходят при условии постоянства свободной энергии Гиббса (∆G°фп = 0). При испарении энтропия вещества возрастает на величину
∆Sисп= 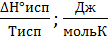 .
.
Количество воды, содержащееся в 250г составляют
ν = 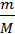 =
= 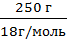 г = 13,88 моль.
г = 13,88 моль.
Отсюда теплота испарения 250 г воды равна:
∆Н°= ν•∆Н°исп = 13,88моль ∙ 44,08 кДж/моль = 611,83кДж = 611830Дж.
Изменение энтропии при испарении 250 г воды при Т=25 + 273 = 298К.
∆Sисп= 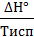 =
= 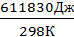 = 2050 Дж/К.
= 2050 Дж/К.
Дата добавления: 2021-01-26; просмотров: 681;











