А.3 Равновесие при адсорбции
Количество вещества, адсорбированное единицей массы или объема адсорбента при достижении состояния равновесия, зависит от температуры и концентрации поглощаемого вещества в газовой смеси. Эта зависимость запишется в виде:
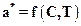 ,(А.1)
,(А.1)
или при постоянной температуре (Т = const)
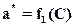 ,(А.2)
,(А.2)
где a* - концентрация поглощаемого вещества в адсорбенте, равновесная с концентрацией его в газовой фазе, кг адсорбата/м3 адсорбента; С- концентрация адсорбтива в газовой фазе, кг адсорбтива/м3.
Концентрация С поглощаемого вещества может быть заменена его парциальным давлением pАв газовой смеси. Тогда изотерма адсорбции примет вид
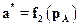 .(А.2а)
.(А.2а)
Изотермы адсорбции определяются опытным путем. Вид изотермы адсорбции зависит от многих факторов: удельной поверхности адсорбента, объема пор, их распределения по размерам, а также от температуры проведения процесса. В качестве примера на рис. А.1 приведены виды типичных изотерм адсорбции для различных веществ, на рис. А.2 - изотермы адсорбции для одного вещества при различных температурах его проведения.
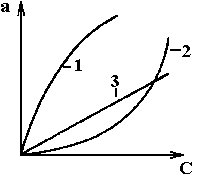 Рис. А.1 Изотермы адсорбции для
различных веществ:
1 – выпуклая, 2 – вогнутая, 3 - линейная
Рис. А.1 Изотермы адсорбции для
различных веществ:
1 – выпуклая, 2 – вогнутая, 3 - линейная
| 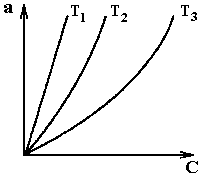 Рис. А.2 Изотермы адсорбции для одного вещества при различных температурах:
Т1<Т2<Т3
Рис. А.2 Изотермы адсорбции для одного вещества при различных температурах:
Т1<Т2<Т3
|
Адсорбция сопровождается уменьшением парциального давления поглощаемого компонента из газовой смеси и заметным выделением тепла. Поэтому, в соответствии с принципом Ле-Шателье, количество адсорбированного вещества возрастает с понижением температуры и повышением давления. Из этого следует, что повышение температуры и понижение давления отрицательно влияют на процесс адсорбции, способствуя десорбции поглощенного вещества из адсорбента.
Дата добавления: 2020-07-18; просмотров: 792;











