Адсорбция твердым веществом из раствора электролита
В растворах электролитов молекулы растворенного вещества распадаются на положительно заряженные катионы и отрицательно заряженные анионы. На поверхности твердого сорбента из раствора адсорбируются преимущественно ионы одного вида, который определяется природой адсорбента и свойствами ионов: зарядом, радиусом и степенью гидратации. По механизму различают специфическую и обменную адсорбцию ионов.
Специфическая адсорбция. На поверхности твердой фазы адсорбируются ионы одного знака – потенциалопределяющий ион. Поверхность при этом приобретает электрический заряд. Вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом – противоионы, т.е. образуется двойной электрический слой. На поверхности кристаллического твердого тела из раствора электролита преимущественно адсорбируется ион, способный достраивать его кристаллическую решетку или образовывать с одним из ионов, входящих в состав кристалла, малорастворимое соединение (правило Фаянса–Панетта). На рис. 2.6 приведена схема образования двойного электрического слоя при сорбции катиона (а) и аниона (б). В первом случае поверхность заряжается положительно, потенциалопределяющий ион – катион, а во втором – отрицательно, потенциалопределяющий ион–анион.
|
| ||||
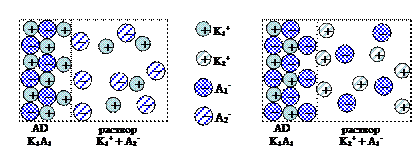
Рис. 2.6. Схема образования двойного электрического слоя
при сорбции катиона (а) и аниона (б)
Обменная адсорбция. Происходит обмен ионов, содержащихся в растворе, и ионов поверхностного слоя твердой фазы. Адсорбент поглощает из раствора катионы или анионы и вместо них выделяет в раствор эквивалентное число других ионов того же знака.
Твердые вещества, способные к ионному обмену и используемые для адсорбции ионов из растворов, называются ионитами. Иониты могут быть органическими или неорганическими, синтетическими и природными. Ионит представляет собой жесткий каркас, имеющий положительный или отрицательный заряд, который скомпенсирован ионами противоположного знака. Противоионы могут замещаться на другие ионы того же знака. Иониты, обладающие катионообменными свойствами, называются катионитами, а обладающие анионообменными свойствами − анионитами. Как правило, катиониты используются в H-форме (про-тивоион – ион H+), а аниониты – в OH-форме (противоион –
ион OH-).
Ионный обмен является обратимым стехиометрическим процессом: катионит R-O-H + Kt+ ↔ R-O-Kt + H+, анионит R-O-H + + An– ↔ R-An + OH–.
Величина прочности связи иона с ионитом зависит от природы иона. В частности, ионообменное равновесие при увеличении концентрации ионов H+ возвращает катионит в H-форму, а при увеличении концентрации OH– ионов − анионит в OH-форму. Таким образом проводят регенерацию катионитов и анионитов. Обменная емкость ионитов, количество сорбированых ионов, составляет величину ~10-3–10-2 моль/г однозарядных ионов.
Иониты находят широкое применение для очистки воды от ионных примесей − деминерализация воды, например катионит марки КУ-2 и анионит марки АВ-17 (синтетические органические смолы с функциональными ионообменными группами).
Дата добавления: 2020-10-25; просмотров: 992;











