ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ
Вторым фактором, влияющим на скорость реакции (после концентрации реагентов), является температура.
Существует эмпирическое правило, по которому скорость большинства химических реакций возрастает примерно в 2-4 раза при повышении температуры на 10 градусов.
Эта зависимость была описана Вант-Гоффом и носит его имя
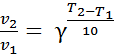 . (6.4)
. (6.4)
Величина g- называется температурным коэффициентом.
Однако это не всегда справедливо.
Для реакций, в которых участвуют очень большие молекулы, например, скорость реакции денатурации яичного альбумина (процесс, происходящий при варке яиц), при повышении температуры на 10 градусов возрастает приблизительно в 50 раз.
Если произвести расчеты ожидаемых скоростей реакций по молекулярно-кинетической теории, то окажется, что реальные скорости, как правило, во много раз ниже ожидаемых. По-видимому, не каждый акт столкновения молекул реагирующих веществ приводит к их химическому взаимодействию, т.е. не каждая молекула вещества способна при данных условиях вступить в химическое взаимодействие. Это можно объяснить тем, что часть молекул, не обладая достаточным запасом кинетической энергии, при столкновении упруго отталкиваются за счет межмолекулярных сил и в реакцию не вступают.
Поскольку концентрация веществ от температуры не зависит, то влияние Т на скорость реакции определяется ее влиянием на константу скорости реакции.
Эта зависимость была установлена Аррениусом:
k = A0 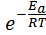 . (6.5)
. (6.5)
В этом уравнении вероятностный множитель А0 учитывает число соударений молекул, вероятность распада промежуточного состояния на исходные вещества и т.д. В первом приближении А0 не зависит от температуры Еa,кДж/моль - энергия активации реакции, R – газовая постоянная, Т,К – температура.
Аррениус высказал гипотезу о том, что в химическую реакцию могут вступить только те частицы, запас энергии которых выше некоторого уровня, который необходим для преодоления сил отталкивания между молекулами. Таким образом, он ввел понятие ЭНЕРГЕТИЧЕСКОГО БАРЬЕРА РЕАКЦИИ. Все молекулы, энергия которых равна или выше энергетического барьера, находятся в особом состоянии, называемом АКТИВИРОВАННЫМ КОМПЛЕКСОМ. (рис.6.1).
ΔНхр= 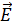 а -
а - 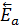 , (6.6)
, (6.6)
 < 0
> < 0
>
|
 0 0
|
| ∆Hх.р> 0 |
| координата реакции |
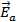
|

|
| ∆Hх.р< 0 |
| H |
| A+B |
| C+D |
| ПС |
| ΣHреагентов |
| ΣHпродуктов |
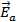
|

|
| C+D |
| ПС |
| A+B |
| ΣHпродуктов |
| ΣHреагентов |
| а) |
| б) |
Рис. 6.1. Энергетические диаграммы: а) экзотермической и б) эндотермической реакций общего вида A + B = C + D
Н – энтальпия, 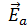 – энергия активации прямой реакции,
– энергия активации прямой реакции, 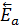 - энергия активации обратной реакции; ПС – переходное состояние (активированный комплекс).
- энергия активации обратной реакции; ПС – переходное состояние (активированный комплекс).
Это состояние является переходным (ПС), и время его существования не превышает 10-14с. В нем как бы уже нет исходных молекул, но еще и нет продуктов реакции. Разность между энергией переходного состояния и средней энергией молекул исходных веществ и является энергией активации данной реакции. Энергия системы в переходном состоянии является максимальной, поэтому частицы в этом состоянии крайне неустойчивы. Из них могут
образоваться как начальные вещества, так и конечные. Если средний уровень энергии молекул в конечном состоянии ниже, чем в исходном, то такая реакция идет с выделением тепла.
Из энергетических диаграмм видно, что тепловой эффект реакций может быть рассчитан как разность энергий активации прямой и обратной реакций.
Энергия активации Еа - один из основных параметров, характеризующих скорость химической реакции. Она определяется, прежде всего, природой реагирующих веществ. Чем выше Еа, тем ниже скорость реакции при прочих равных условиях. Энергия активации расходуется на ослабление химических связей в исходных реагирующих веществах и на преодоление отталкивательного взаимодействия между электронными оболочками реагирующих частиц. Чем больше энергия связи в исходных молекулах, тем выше энергия активации. Максимальными энергиями активации характеризуются реакции между молекулами с прочными ковалентными связями. Для реакций между ионами Еа достаточно мала, так как разноименно заряженные ионы обычно сильно притягиваются друг к другу и затрат энергии на преодоление сил отталкивания не требуется. Энергия активации всегда меньше энергии химических связей в исходных молекулах, и ее не достаточно для их разрыва. Энергия активации расходуется на образование активированного комплекса, а остаток необходимой энергии появляется при начале образования новых связей между наиболее активными частицами.
Понятие энергии активации имеет физический смысл лишь для элементарных реакций и сложных реакций с одной лимитирующей стадией.
Обычно считается, что реакции у которых Еа >150кДж/моль, при стандартных условиях практически не идут. Таким образом, энергия активации и является тем кинетическим фактором, благодаря которому реакции вполне разрешенные с точки зрения химической термодинамики (ΔGхр< 0), на практике не идут. Для случая, когда Еа = 0 (безбарьерные реакции), константа скорости равна предэкспоненциальному множителю А0 и является максимально возможной. Однако реальные скорости реакций и в этих условиях чаще всего ниже теоретически возможных. Это объясняется тем, что для химического взаимодействия молекулам необходим не только избыток энергии, равный Еа, но еще и определенная их взаимная ориентация. Влияние пространственной ориентации молекул на скорость реакции (или на константу скорости) может быть учтено с помощью СТЕРИЧЕСКОГО (вероятностного) фактора Р, который характеризует долю молекул, реально вступающих в химическую реакцию от числа молекул, имеющих достаточную энергию для этого акта. Величина стерического коэффициента для различного типа молекул колеблется от 1 до 10-9. Причем чем крупнее молекулы, тем сложнее им сориентироваться в пространстве для химического взаимодействия и тем меньше величина стерического коэффициента.
Дата добавления: 2021-01-26; просмотров: 444;











