ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Если в ходе химической реакции одно из реагирующих веществ расходуется полностью, то такая реакция называется необратимой. К разряду необратимых реакций с хорошей долей приближения можно отнести реакции, идущие с образованием газов, труднорастворимых и малодиссоциирующих веществ.
Возможность образования таких соединений может служить критерием того, возможна данная реакция или нет.
Однако большое число химических реакций визуально прекращается задолго до того, как исходные вещества израсходовались. В этом случае говорят, что реакция достигла состояния равновесия.
Рассмотрим процесс достижения этого состояния на примере реакции взаимного превращения двуокиси и четырехокиси азота. Двуокись азота - газ, имеющий темно-бурую окраску, при охлаждении подвергается димеризации, образуя новое вещество N2O4, не имеющее окраски.
Если в стеклянный сосуд при высокой температуре и нормальном давлении поместить двуокись азота, запаять этот сосуд, а затем начать его охлаждать, то мы увидим, как окраска постепенно бледнеет, а затем выпадают бесцветные кристаллы.
Этот переход соответствует реакции 2NO2 → N2O4. Повторное нагревание колбы приводит к окрашиванию газа N2O4 → 2NO2. Если зафиксировать температуру при стандартных условиях, то в колбе будет газ светло - бурой окраски, которая не будет изменяться сколь угодно долго. Таким образом, при комнатной температуре в сосуде присутствуют оба газа, находящиеся в равновесии.
Прямая реакция 2NO2 → N2O4 является реакцией второго порядка, и ее скорость будет равна
ν1 = k1 [NO2]2
Обратная реакция N2O4 → 2NO2 является реакцией первого порядка и ее скорость будет равна
ν2 = k2 [N2O4]
При условии химического равновесия скорость прямой реакции равна скорости обратной, т.е. начиная с этого момента в системе устанавливаются некоторые концентрации обоих газов, которые в дальнейшем не изменяются.
k1[NO2]2 = k2[N2O4] или К = 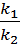 .
.
Это уравнение определяет состояние химического равновесия данной реакции, а величина К - КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ. Видно, что она равна отношению констант скоростей прямой и обратной реакций.
В общем случае для реакции aA + bB + … ⇄ cC + dD + … константа химического равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентам.
 =
= 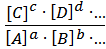 . (6.7)
. (6.7)
Константа химического равновесия не зависит от механизма реакции и определяет глубину ее протекания до момента достижения равновесного состояния. Чем больше константа равновесия, тем больше степень превращения реагентов в продукты.
Константа химического равновесия так же, как и константы скоростей реакций, являются функциями только температуры и природы реагирующих веществ и не зависят от их концентрации.
Для гетерогенных процессов концентрация твердых веществ в выражение скорости реакции и константы химического равновесия не включается, так как реакция протекает на поверхности твердой фазы, концентрация которой остается во времени постоянной. Например, для реакции
FeO(тв) + CO(г) ⇄ Fe(тв) + CO2(г)
выражение константы равновесия будет иметь вид:
 =
=  ,
, 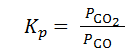 .
.
Из термодинамики известно, что убыль свободной энергии химической реакции, идущей при p,T = const, не зависит от пути процесса и равна максимальной полезной работе реакции:
D G = -Amax . (6.8)
Чем отрицательнее DGхр, тем сильнее выражена принципиальная возможность данного процесса.
Рассмотрим химическую реакцию, протекающую обратимо при p,T = const в газовой фазе A + B = C + D.
Для газов A = υRT ln 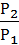 , где Р2 и Р1 конечное и начальное давление в системе. Тогда для нашего случая
, где Р2 и Р1 конечное и начальное давление в системе. Тогда для нашего случая
-DG = υRT lnPc 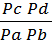 , где
, где 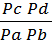 = Кр.
= Кр.
Из этих уравнений вытекает взаимосвязь между изменением свободной энергии Гиббса и константой химического равновесия:
DG = - RT ln Kp,(6.9)
Это выражение лежит в основе термодинамических расчетов констант равновесия и, следовательно, равновесных выходов продуктов реакции.
Учитывая, что для газов Рi = CiRT, константу равновесия можно выразить через молярные концентрации реагирующих веществ
Kc = 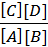
Cвязь между Кр и Кс выражается уравнением
Кр = (RT)DυKc , (6.10)
где Dυ - изменение числа молей газообразных веществ в ходе реакции.
Из соотношения DG = -RTlnK следует, что чем больше убыль свободной энергии Гиббса, тем больше константа равновесия. Зная изменение свободной энергии в химической реакции и рассчитав К по закону действующих масс, можно определить равновесные концентрации реагирующих веществ.
Соотношение между G и К является универсальным и применимо к любому типу равновесных процессов: диссоциации электролитов, равновесию жидкость - насыщенный пар, растворенное вещество – насыщенный раствор, позволяет рассчитывать константы равновесия окислительно-восстановительных реакций.
«ХИМИЧЕСКОЕ РАВНОВЕСИЕ - ЭТО УСТОЙЧИВОЕ СОСТОЯНИЕ, ПРИ КОТОРОМ РЕАКЦИИ В ПРЯМОМ И ОБРАТНОМ НАПРАВЛЕНИИ ИДУТ С РАВНЫМИ СКОРОСТЯМИ».
К состоянию равновесия можно подойти, взяв в качестве исходных веществ А и В, либо С и Д, так как положение истинного равновесия не зависит от состава исходной смеси, то есть не зависит от того, с какой стороны к нему подходят.
Поскольку уравнение для константы химического равновесия выводится из условия равенства скоростей прямой и обратной реакций, то в это выражение входят не начальные, а равновесные концентрации веществ, не зависящие от времени. Равновесная концентрация вещества определяется как разность между исходной концентрацией вещества и тем количеством вещества, которое прореагировало к моменту равновесия.
Дата добавления: 2021-01-26; просмотров: 452;











