СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
В рамках раздела химической термодинамики мы рассмотрели вопросы, связанные с принципиальной возможностью протекания химических реакций и условиями наступления состояния равновесия. При рассмотрении любого химического процесса возникают два вопроса. Первый - возможна ли данная реакция вообще при данных условиях? Второй – при каких условиях данная реакция будет протекать достаточно быстро, что бы этот процесс имел практическое значение? Первый вопрос разрешен в рамках термодинамики: процесс принципиально возможен, если в результате этой реакции свободная энергия системы убывает (ΔGхр < 0). Однако, на пути этой реакции могут возникать достаточно большие затруднения, которые в реальных условиях делают реакцию практически невозможной. Разрешением второго вопроса занимаются в рамках раздела химии, называемого химическая кинетика.
Химическая кинетика – это раздел химии, в котором изучают влияние внешних факторов на скорость химической реакции, ее механизм и быстроту наступления состояния равновесия.
Рассматриваются только реакции, которые термодинамически разрешены (DGхр< 0). В химических реакциях происходит превращение одного или нескольких химических веществ, называемых исходными веществами (реагентами), в одно или несколько других химических веществ, называемых продуктами реакции.
Для завершения любой химической реакции нужно некоторое время, причем одни реакции идут медленно, другие быстро. Примером очень быстрых реакций могут служить реакции между ионами, которые не сопровождаются изменением степеней окисления, например, реакция нейтрализации между сильной кислотой и сильным основанием. Эта реакция протекает с той же скоростью, что и смешение растворов, т.е. практически каждое столкновение между ионом водорода и ионом
гидроксида приводит к химическому превращению их в молекулы воды. К таким же быстрым реакциям можно отнести реакции образования осадков трудно растворимых веществ.
Примером очень медленной реакции может служить термодинамически разрешенное взаимодействие между водородом и кислородом с образованием воды при комнатной температуре.
Если реакция протекает во всем объеме (в одной фазе), то реакция является гомогенной, а если на границе раздела фаз (на поверхности) – гетерогенной.
Химическая реакция, как правило, осуществляется не простым превращением исходных частиц в продукты реакции, а состоит из нескольких стадий. В этих стадиях происходит образование промежуточных частиц, которые затем расходуются в последующих стадиях. Промежуточные частицы могут представлять из себя неустойчивые, коротко живущие молекулы, ионы и свободные радикалы. Совокупность промежуточных стадий, в результате которых образуются продукты реакции, называют «механизмом химической реакции».
Кинетические характеристики реакции, такие как скорость, концентрации реагентов и промежуточных частиц, неразрывно связаны с механизмом реакции в отличие от изменения термодинамических функций (энтальпии, энтропии, свободной энергии и констант равновесия), которые никак не связаны с путем реакции, а определяются их начальным и конечным состояниями.
Скоростью химической реакции называют изменение концентрации реагирующих веществ или продуктов реакции (DС) в единицу времени: 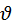 =
= 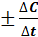
 . Скорость реакции измеряется в моль/л∙с, если она идет во всем объеме системы (гомогенная реакция) и в моль/м2∙с, если реакция идет на границе раздела фаз (гетерогенная реакция). Средняя скорость реакции
. Скорость реакции измеряется в моль/л∙с, если она идет во всем объеме системы (гомогенная реакция) и в моль/м2∙с, если реакция идет на границе раздела фаз (гетерогенная реакция). Средняя скорость реакции 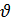 ср. в интервале времени от t1 до t2 определяется соотношением
ср. в интервале времени от t1 до t2 определяется соотношением
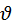 ср =
ср = 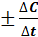 , где DС = С2 - С1 , Dt = t2 - t1; С1 и С2 – молярная (моль/л) концентрация любого участника реакции в моменты времени t1 и t2 соответственно.
, где DС = С2 - С1 , Dt = t2 - t1; С1 и С2 – молярная (моль/л) концентрация любого участника реакции в моменты времени t1 и t2 соответственно.
Знак (-) перед дробью относится к изменению концентраций исходных веществ, DС< 0; знак (+) - к изменению концентраций продуктов реакции, DС > 0.
Мгновенная скорость – это скорость реакции в момент времени t. Она определяется производной от концентрации по времени 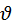 t =
t = 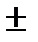
 (моль/л∙с; моль/л∙час).
(моль/л∙с; моль/л∙час).
Скорость реакции aA + bB → cC + dD экспериментально можно определять либо по убыли концентраций исходных веществ, либо по увеличению концентраций продуктов реакции:
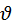 t =
t = 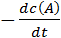 =
= 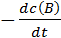 =
=  =
=  . (6.1)
. (6.1)
Скорость реакции в значительной степени зависит от условий ее протекания. Как правило, она со временем уменьшается. Однако известны автокаталитические и цепные реакции, скорость которых во времени нарастает. Можно создать условия, при которых скорость реакции будет оставаться постоянной.
Дата добавления: 2021-01-26; просмотров: 458;











