Влияние внешних факторов на состояние равновесия
Состояние химического равновесия является устойчивым, если в нем система обладает минимальным запасом свободной энергии. Это состояние может продолжаться сколь угодно долго при заданных условиях, т.е. пока параметры, при которых оно сформировалось, остаются неизменными. При изменении условий равновесие нарушится и сместится в ту или другую сторону. Через некоторое время в системе установится новое состояние равновесия, отвечающее новым условиям и новым равновесным концентрациям веществ. Равновесие смещается потому, что изменение условий по-разному влияет на скорость прямой и обратной реакций. Если при изменении внешних условий скорость прямой реакции возросла больше, чем у обратной, то говорят, что равновесие сместилось вправо.
Оценить направление смещения равновесия можно либо при анализе уравнений, описывающих закономерности данной реакции, либо на основе анализа общих принципов, позволяющих оценить результаты изменения внешних условий на равновесные системы.
Одним из таких принципов является принцип Ле Шателье.
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо внешнее воздействие, то равновесие сместится в сторону ускорения той реакции, которая приведет к уменьшению этого воздействия.
1. Изменение концентрации участников реакции. Изменение концентрации одного или нескольких реагентов в равновесной смеси приведет к смещению равновесия согласно уравнениям скорости для прямой и обратной реакций. Если увеличивается концентрация исходных веществ, то увеличивается скорость прямой реакции, тогда как скорость обратной остается неизменной. Это приведет к смещению равновесия вправо. Этот же эффект будет достигнут, если уменьшить концентрацию продуктов реакции, т.к. при этом скорость обратной реакции уменьшится, а скорость прямой останется постоянной. Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т.е. в сторону исходных веществ.
Согласно принципу Ле Шателье система в состоянии равновесия будет стремиться сохранить его. Увеличение концентрации исходных веществ сместит равновесие в сторону реакции, где они будут расходоваться вправо, а увеличение концентрации продуктов – влево. Также поведет себя система при уменьшении концентрации веществ. Снижение концентрации продуктов сместит равновесие в сторону реакции, где они будут восполняться, – вправо, а снижение концентрации исходных веществ – влево.
2.Влияние температуры. Из уравнения DG = -RTlnK следует, чтоlnKp = - 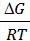 .
.
Учитывая, что DG = DH - TDS, получим lnKp = - 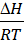 +
+ 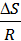 .
.
Таким образом, константа химического равновесия при повышении температуры может как повышаться, так и понижаться. Например, для экзотермических реакций (DНхр <0), с ростом температуры Кр уменьшается и равновесие сдвигается влево, а для эндотермических (DНхр >0) Кр увеличивается и равновесие смещается вправо.
В соответствии с принципом Ле Шателье увеличение температуры сместит равновесие в сторону реакции, где тепло будет поглощаться (в сторону эндотермической реакции). При уменьшении температуры система будет стремиться восполнить потери тепла и равновесие сместится в сторону реакции, где тепло выделяется (в сторону экзотермической реакции).
Следует помнить, что при увеличении температуры скорость всех реакций повышается. Однако скорость эндотермических реакций будет возрастать сильнее, чем у экзотермических.
3.Влияние давления. Давление оказывает воздействие только на концентрацию газов. Чем выше давление, тем больше концентрация. Концентрация жидкостей и твердых веществ от давления не зависит. Таким образом, влияние изменения внешнего давления на состояние равновесия определяется так же, как и влияние концентрации реагентов. Однако учитываются только газообразные вещества.
Принцип Ле Шателье позволяет предсказать направление смещения равновесия следующим образом. Увеличение давления смещает равновесие в сторону реакции, идущей с уменьшением объема, т.е. туда, где образуется меньшее количество газообразных веществ и воздействие давления минимально.
4.Влияние катализаторов. Для обратимых реакций присутствие катализатора не изменяет состояния равновесия. При введении в реакционную среду катализатора потенциальный барьер (энергия активации) уменьшается как для прямой, так и для обратной реакций. Катализатор лишь ускоряет наступление состояния равновесия за счет увеличения скоростей прямой и обратной реакций
РАСТВОРЫ
Растворами называют гомогенные системы, состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения гомогенных свойств.
Если несколько веществ привести в соприкосновение, то можно получить либо механическую смесь, либо однородную смесь, либо химическое соединение. Процесс образования раствора является промежуточным между механическим смешением веществ и химической реакцией. Состав растворов в достаточно широком интервале концентраций, температур и давлений может изменяться непрерывно. Растворы не имеют постоянного состава, и к ним не применимы законы стехиометрии. Это роднит их с механическими смесями. С другой стороны, растворы являются однородными по составу системами и их образование сопровождается значительными объемными и тепловыми эффектами, что напоминает образование химических соединений.
Принято различать истинные и коллоидные растворы, а также грубодисперсные системы. В истинных растворах вещества присутствуют в виде частиц с размерами ионов и молекул 10-9-10-10 м. Коллоидные растворы (золи) имеют размер частиц 10-7-10-9 м. Следующие за ними грубодисперсные системы, имеющие размер частиц больше 10-7см, являются неустойчивыми и без специальной стабилизации саморазрушаются, т.е. происходит расслоение системы на отдельные фазы.
Грубодисперсные системы подразделяют на СУСПЕНЗИИ-твердые частицы в жидкости и ЭМУЛЬСИИ- капли одной жидкости в другой. Типичной суспензией является система, полученная взбалтыванием глины в воде, а типичной эмульсией - молоко.
Примерами коллоидных систем являются водные растворы клея или желатина и АЭРОЗОЛИ - туман (капли жидкости в газе) и дым (твердые частицы в газе). Наиболее характерным отличием коллоидных растворов от истинных является то, что их более крупные частицы сильно рассеивают проходящий через них свет, чего не наблюдается у истинных растворов.
Истинные растворы подразделяют на газообразные (воздух), жидкие (морская вода) и твердые (сплавы).
В газообразном состоянии молекулы очень слабо взаимодействуют друг с другом. Поэтому при нормальном давлении газовые растворы можно считать механической смесью компонентов, однако размеры молекул газов позволяют отнести их к истинным растворам. При образовании газовых растворов объемные и тепловые эффекты не наблюдаются.
Твердые растворы - это системы с переменным составом, в которых частицы различных элементов располагаются в общей кристаллической решетке. Область существования твердых растворов обычно отличается достаточно узкими интервалами концентраций. Однако такие металлы, как медь и серебро, обладают практически полной взаимной растворимостью. Различают твердые растворы замещения и внедрения. В первых структурные единицы (атомы, ионы, молекулы) растворяющегося компонента замещают частицы растворителя в узлах
кристаллической решетки. Этот случай характерен для веществ, имеющих близкие размеры частиц и однотипные кристаллические решетки. Если же эти условия не соблюдаются, то могут образовываться твердые растворы внедрения. В этом случае происходит внедрение структурных единиц растворяемого компонента в междоузлия кристаллической решетки растворителя.
Жидкие растворы, как и все прочие, состоят из растворителя и растворенного вещества. Если растворяемое вещество – жидкость, то это деление условно. Обычно растворителем считают то вещество, которого в данной системе больше. Наиболее типичным и широко распространенным растворителем является вода.
ВОДА
Формула воды Н2О. Относительные весовые количества водорода и кислорода в этом веществе равны 2,016:16,000. В природной воде содержится примерно 99,73% таких молекул, остальное приходится на так называемую «тяжелую воду», где атомы водорода замещены на атомы дейтерия (изотоп водорода с массовым числом 2).
Вода - единственное в природе вещество, которое находится на земле одновременно в трех агрегатных состояниях – твердом, жидком и газообразном.
Вода – одно из наиболее распространенных в природе веществ. Ее запасы на земле оцениваются в 2,7÷2,9 млрд  км3.
км3.
Таблица 7.1
Вода в природе
| Содержание воды, млрд. км3 | ||
| Атмосфера | Земная кора | Гидросфера |
| (1,3÷1,5)10-5 | 1,3÷1,4 | 1,4÷1,5 |
Вода, содержащаяся в гидросфере, на 96% сосредоточена в мировом океане и только 4% - в виде рек, озер, ледников и подземных вод. Запасы пресной воды составляют не более 3%.
При нормальных условиях вода является очень слабым электролитом, т.е. присутствует в растворах в основном в виде молекул, а не ионов.
Концентрация ионов гидроксония ( Н3О+) и гидроксида (ОН-) в чистой воде при стандартных условиях равна 10-7моль/л.
Вода обладает рядом очень специфических свойств, отличающих ее от любых других веществ. Так, большинство веществ при снижении температуры уменьшаются в объеме, при этом увеличивается их плотность. Вода имеет максимальную плотность при температуре +3,980С. При дальнейшем понижении температуры ее объем начинает возрастать, а плотность снижаться. Плотность воды в твердой фазе ниже, чем в жидкой, поэтому лед плавает. Температура замерзания и кипения воды значительно выше, чем можно было ожидать в сравнении с родственными ей соединениями. У воды необычно высокая диэлектрическая проницаемость, что делает ее одним из сильнейших растворителей.
Для большинства твердых веществ у каждой из частиц в среднем 12 ближайших соседей, в жидкостях - 10¸11. У воды каждая молекула окружена
лишь четырьмя соседями, связанными с ней специфическими водородными связями, которые по энергии почти в 10 раз превышают электростатические силы. Водородные связи существуют как в твердом, так и в жидком состоянии. Поэтому даже в жидкой воде сохраняется квазистационарная кристаллическая решетка и молекулы имеют значительные ограничения в своей подвижности. Кипячение или другие сильные воздействия на воду разрушают эти «льдоподобные» структуры, что в значительной степени изменяет ее физико-химические свойства. Восстановление структуры и свойств воды требует нескольких дней. В настоящее время молекулярная структура воды до конца не выяснена.
Дата добавления: 2021-01-26; просмотров: 560;











