Оксиды элементов IV группы.
Главную подгруппу четвертой группы периодической системы образуют пять элементов — углерод, кремний, германий, олово и свинец.
При переходе от углерода к свинцу размеры атомов возрастают. Поэтому следует ожидать, что способность к присоединению электронов, а следовательно, и неметаллические свойства будут при этом ослабевать, легкость же отдачи электронов — возрастать. Действительно, уже у германия проявляются металлические свойства, а у олова и свинца они преобладают над неметаллическими. Таким образом, только первые два члена описываемой группы являются неметаллами, германий причисляют и к металлам, и к неметаллам, олово и свинец — металлы.
Для элементов рассматриваемой группы характерны степени окисления +2 и +4.
Углерод
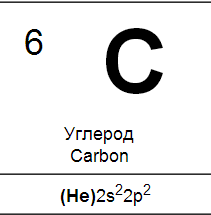 Углерод является типичным неметаллом. При низких температурах и уголь, и графит и, в особенности, алмаз инертны. При нагревании их активность увеличивается: уголь легко соединяется с кислородом и служит хорошим восстановителем.
Углерод является типичным неметаллом. При низких температурах и уголь, и графит и, в особенности, алмаз инертны. При нагревании их активность увеличивается: уголь легко соединяется с кислородом и служит хорошим восстановителем.
С кислородом углерод образует диоксид углерода СО2, часто называемый так-же углекислым газом, и оксид углерода (II), или монооксид углерода, СО.
Диоксид углерода СО2 постоянно образуется в природе при окислении органических веществ (гниение растительных и животных остатков, дыхание, сжигание топлива).
В лабораториях диоксид углерода обычно получают, действуя на мрамор СаСОз соляной кислотой в аппарате Киппа:
СаСО3 + 2НС1 = СаС12 + Н20 + С02 .
В промышленности большие количества диоксида углерода получают при обжиге известняка:
СаСО3 = Са0 + С02
Диоксид углерода при обычных условиях — бесцветный газ, примерно в 1,5 раза тяжелее воздуха, благодаря чему его можно переливать, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.
Раствор СO2 в воде имеет кисловатый вкус и обладает слабокислой реакцией, обусловленной присутствием в растворе небольших количеств угольной кислоты Н2СО3, образующейся в результате обратимой реакции:
С02 + Н20 <=> Н2СО3 .
Таким образом, диоксид углерода является ангидридом угольной кислоты.
Равновесие последней реакции сильно сдвинуто влево, лишь очень небольшое количество растворенного С02 превращается в угольную кислоту.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением С02. Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов, например:
MgC03 = Mg0 + C02
Карбонат кальция нерастворим в воде. Поэтому известковая вода (раствор гидроксида кальция) при пропускании через нее диоксида углерода мутнеет:
Са(ОН)2 + С02 = СаС03 + Н20.
Однако, если пропускать С02 через известковую воду долгое время, то мутная вначале жидкость постепенно светлеет и наконец становится совершенно прозрачной. Растворение происходит вследствие образования кислой соли — гидрокарбоната кальция:
СаС03 + Н20 + С02 = Са(НС03)2 .
Оксид углерода (II), или монооксид углерода, СО — бесцветный ядовитый газ. В воде оксид углерода растворим очень мало и не вступает с ней в химическое взаимодействие.
Реакция образования оксида углерода (II) из простых веществ описывается уравнением:
С(К) + ½ 02(г) = СО(г)
Изменение стандартной энергии Гиббса в этой реакции равно —137 кДж, однако соответствующее значение в реакции
С(К) + 02(г) = СО2(к) Т
гораздо более отрицательно (—394 кДж). Поэтому при невысоких температурах уголь сгорает до СО2, а оксид углерода, даже при недостатке кислорода, почти не образуется. Иначе обстоит дело при повышении температуры. По достижении 400—500 °С начинает протекать реакция между углем и образовавшимся диоксидом углерода:
С(к) + С02(г) = 2СО(Г)
В лабораториях оксид углерода (П) обычно получают, прибавляя муравьиную кислоту НСООН к нагретой серной кислоте. Последняя отнимает от муравьиной кислоты воду, выделяя оксид углерода (II):
НСООН = СO +H2O.
Эта реакция показывает, что оксид углерода (II) можно рассматривать как ангидрид муравьиной кислоты. Хотя муравьиная кислота не может быть получена непосредственно из оксида углерода (II) и воды, соли ее образуются при взаимодействии едких щелочей с оксидом углерода при 150—200°С:
NaOH + СО = HCOONa.
На воздухе оксид углерода горит голубоватым пламенем с выделением большого количества теплоты, превращаясь в СО2:
2СО(г) + 02(г) = 2С02(г)
Оксид углерода (II) соединяется со многими металлами, образуя карбонилы металлов, например пентакарбонил железа Fe(CO)5, тетракарбонил никеля Ni(CO)4. Последние два вещества представляют собой летучие, весьма ядовитые жидкости.
При повышенной температуре оксид углерода (II) — хороший восстановитель, играющий важную роль в металлургии при восстановлении металлов из их оксидов.
Кремний
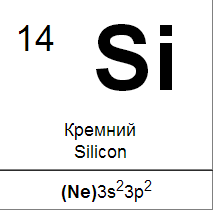 Кремний образует два оксида: монооксид SiO и диоксид SiO2.
Кремний образует два оксида: монооксид SiO и диоксид SiO2.
Монооксид кремния – неустойчивое соединение, на воздухе медленно окисляется до SiO2.
Диоксид кремния. Наиболее стойким соединением кремния является диоксид кремния, или кремнезем, SiO2.
Кристаллический диоксид кремния находится в природе главным образом в виде минерала кварца. Прозрачные, бесцветные кристаллы кварца, имеющие форму шестигранных призм с шестигранными пирамидами на концах, называются горным хрусталем (рис. 16.5).
Из мелких зерен кварца состоит обычный песок. Чистый песок — белого цвета, но чаще он бывает окрашен соединениями железа в желтый или красноватый цвет.
Кристаллический диоксид кремния очень тверд, нерастворим в воде и плавится около 1610 °С, превращаясь в бесцветную жидкость. По охлаждении этой жидкости получается прозрачная стекловидная масса аморфного диоксида кремния, по виду сходного со стеклом.
Аморфный диоксид кремния распространен в природе гораздо меньше, чем кристаллический. На дне морей имеются отложения тонкого пористого аморфного кремнезема.
Кислоты, за исключением плавиковой, не действуют на диоксид кремния. Плавиковая же кислота легко вступает с ним в реакцию, образуя фторид кремния и воду.
Химические свойства различных модификаций сходны между собой.
1. Взаимодействие с металлами
При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
2. Взаимодействие с неметаллами
Реагирует с водородом:
SiO2 + 2Н2 = Si + 2Н2O.
Взаимодействует с углеродом:
SiO2 + 3С = SiС + 2СO.
3. Свойства кислотного оксида
Диоксид кремния – типичный кислотный оксид, но не растворяется в воде, при сплавлении реагирует со щелочами:
SiO2 + 2KOH = K2SiO3 + H2O,
основными оксидами:
SiO2 + MgО = MgSiO3.
и карбонатами щелочных металлов:
SiO2 + K2CO3 = K2SiO3 + CO2.
С кислотами не реагирует, исключение составляет плавиковая кислота:
SiO2 + 6HF = H2SiF6 + 2H2O.
Германий
Диоксид германия GeO2 — белые кристаллы, заметно растворимые в воде, причем раствор проводит электрический ток. Получают GeO2 различными способами; в частности, он может быть получен нагреванием германия в кислороде или окислением его концентрированной азотной кислотой.
Диоксид германия — амфотерное соединение с сильно преобладающими кислотными свойствами, вследствие чего он легко растворяется в щелочах, образуя германаты.
Олово
Оксид олова (II) SnO — темно-бурый порошок, образующийся при разложении гидроксида олова (II) Sn(OH)2 в атмосфере диоксида углерода.
Диоксид олова Sn02 встречается в природе и может быть получен искусственно сжиганием металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта.
Свинец
Первая металлургическая операция при получении свинца — это обжиг, в ходе которого сульфид свинца превращается в оксид:
PbS + 302 = 2РbО + 2S02 .
Оксид свинца (II) РЬО — желтый порошок, образующийся при нагревании расплавленного свинца на воздухе.
Диоксид свинца РbО2 — темно-бурый порошок, образующийся при действии сильных окислителей на оксид или соли свинца (II). Диоксид свинца, подобно диоксиду олова, представляет собой амфотерный оксид с преобладанием кислотных свойств.
При сплавлении диоксида свинца с оксидом кальция образуется плюмбат кальция СаРbО3:
СаО + РЬ02 = СаРbО3 .
Основные свойства диоксида свинца проявляются в образовании очень нестойких солей свинца (IV). Так, при действии на диоксид свинца соляной кислоты в первый момент образуется хлорид свинца (IV) РbСl4, который, однако, легко отщепляет хлор, переходя в хлорид свинца (II) РЬСl2:
РЬ02 + 4НС1 = РЬСl4 + 2Н20;
РЬС14 = РЬС12 + С12
Все соединения свинца (IV) — очень сильные окислители. Практическое применение в качестве окислителя в химической промышленности имеет РЬО2/
Билет 13
Дата добавления: 2016-10-07; просмотров: 5593;











