Атомная масса (атомный вес) природного элемента. Изотопный состав элементов. Дефект массы.
В природе элементы за редким исключением существуют в виде смесей из нескольких изотопов. Это ведет к тому, что атомный весприродного элемента несколько отличается от атомного веса любого из его чистых изотопов. Легче всего это понять из таблицы 2-2, где приведены атомные веса природных элементов и их изотопный состав.
Таблица 2-2. Символы, названия, атомные веса и природный изотопный состав некоторых химических элементов.
| Элемент и его символ с массовым числом и зарядом ядра | Латинское название (как читается) | Атомный вес природного элемента | Атомный вес изотопов | Содержание изотопов в природном элементе, % |
| Водород 11H 21H (D) | Hydrogenium (гидрогениум) | 1,0079 | ...... 1,0078 2,0140 | ...... 99,984 0,0156 |
| Углерод 126C 136C | Carboneum (карбониум) | 12,011 | ...... 12,00000 13,00335 | ...... 98,892 1,108 |
| Азот 147N 157N | Nitrogenium (нитрогениум) | 14,0067 | ...... 14,00307 15,00011 | ...... 99,635 0,365 |
| Кислород 168O 178O 188O | Oxygenium (оксигениум) | 15,9994 | ...... 15,99491 16,9991 17,9992 | ...... 99,759 0,037 0,204 |
| Натрий 2311Na | Natrium (натриум) | 22,9898 | ...... 22,9898 | ...... |
| Хлор 3517Cl 3717Cl | Chlorum (хлорум) | 35,453 | ...... 34,96885 36,9658 | ...... 75,53 24,47 |
Названия элементов на латинском и русском языке и латинские символы этих элементов приведены для того, чтобы мы постепенно начинали знакомиться со всеми элементами. Из таблицы видно, что средний измеренный атомный вес найденного в природе элемента зависит от того, сколько в нем содержится разных изотопов.
Итак, в первой колонке таблицы 2-2 приведено русское название элемента. Ниже - латинский символ элемента, связанный обычно с его латинским названием. Слева вверху от символа элемента указываются массовое число (сумма протонов и нейтронов в ядре), а слева внизу - заряд ядра атома (количество протонов). Например:
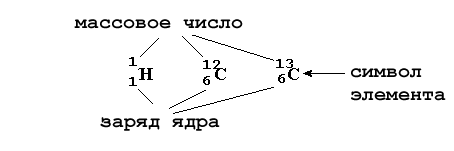
Как видно из таблицы 2-2, атомные веса элементов, найденных в природе в виде единственного изотопа (например, натрия), в точности равны атомному весу этого изотопа. Иначе обстоит дело с элементами, которые существуют на Земле в виде нескольких изотопов (например, хлор, кислород): их атомный вес зависит от того, какой изотоп этого элемента наиболее распространен и сколько в нем "примесей" других изотопов этого элемента.
Дата добавления: 2016-11-04; просмотров: 2393;











