Азотная кислота и ее свойства.
Чистая азотная кислота HNO3 — бесцветная жидкость. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влиянием света она постепенно разлагается:
4HN03 = 4N02 + 02 + 2Н20.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот: в разбавленных растворах она полностью распадается на ионы Н+ и N0_.
Азотная кислота — один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор —в фосфорную.
Азотная кислота действует почти на все металлы (см. разд. 11.3.2), превращая их в нитраты, а некоторые металлы — в оксиды.
Концентрированная HNO3 пассивирует некоторые металлы.
Степень окисления азота в азотной кислоте равна +5. Выступая в качестве окислителя, HNO3 может восстанавливаться до различных продуктов:
+4 +3 +2 +1 0 -3
N02 N203 NO N2О N2 NH4N03
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрация HNO3, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется N0. В случае более активных металлов — железа, цинка — образуется N2O. Сильно разбавленная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием — с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Си + HN03(конц.) —► Cu(N03)2 + N02 + Н20;
Си + HN03 (разбавл.) —^ Си(N03) 2 + N0 + Н2О;
Mg + HN03 (разбавл.) —> Mg(N03)2 + N20 + н20 ;
Zn + HN03(очень разбавл.) —► Zn(N03)2 + NH4N03 + Н20.
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до N02, например
S + 6HNO3 = H2S04 + 6N02 + 2Н20.
Более разбавленная кислота обычно восстанавливается до N0, например:
ЗР + 5HN03 + 2Н20 = ЗН3РО4 + 5N0
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием HNO3, протекают сложно.
Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет не-которые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (1П), или хлорида нитрозила, N0C1:
+5 +3
HN03 + ЗНС1 = С12 + 2Н20 + N0C1.
Хлорид нитрозила является промежуточным продуктом реакции и разлага-ется:
2N0C1 = 2N0 + С12 .
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям:
Au + HN03 + ЗНС1 = AuCl3 + NO + 2Н20;
3Pt + 4HN03 + 12НС1 = 3PtCl4 + 4N0 + 8Н20.
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами — NO2. Этот процесс называется нитрованием и имеет большое значение в органической химии.
Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
2KN03 = 2KN02 +О2
Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При описании свойств аммиака было указано, что он горит в кислороде, причем продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение NH3 в N0:
4NH3(r) + 5О2(г) = 4NO(r) + 6Н2О(г), АН = —907 кДж.
Образовавшийся N0 легко переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют.
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45 %, а концентрированная - 98 и 97 %. Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
Билет 5
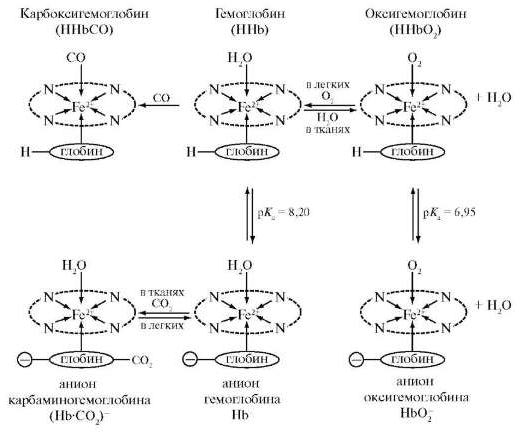
2. Роль железа в процессе жизнедеятельности организма.
Железо в организме. Железо присутствует в организмах всех животных и в растениях (в среднем около 0,02%); оно необходимо главным образом для кислородного обмена и окислительных процессов. Существуют организмы (так называемые концентраторы), способные накапливать его в больших количествах (например, железобактерии - до 17-20% Железа). Почти все Железо в организмах животных и растений связано с белками. Недостаток Железа вызывает задержку роста и явления хлороза растений, связанные с пониженным образованием хлорофилла. Вредное влияние на развитие растений оказывает и избыток Железа, вызывая, например, стерильность цветков риса и хлороз. В щелочных почвах образуются недоступные для усвоения корнями растений соединения Железа, и растения не получают его в достаточном количестве; в кислых почвах Железо переходит в растворимые соединения в избыточном количестве. При недостатке или избытке в почвах усвояемых соединений Железа заболевания растений могут наблюдаться на значительных территориях.
В организм животных и человека Железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, шпинат, свекла). В норме человек получает с рационом 60-110 мг Железа, что значительно превышает его суточную потребность. Всасывание поступившего с пищей Железа происходит в верхнем отделе тонких кишок, откуда оно в связанной с белками форме поступает в кровь и разносится с кровью к различным органам и тканям, где депонируется в виде Железо-белкового комплекса - ферритина. Основное депо Железа в организме - печень и селезенка. За счет ферритина происходит синтез всех железосодержащих соединений организма: в костном мозге синтезируется дыхательный пигмент гемоглобин, в мышцах - миоглобин, в различных тканях цитохромы и других железосодержащие ферменты. Выделяется Железо из организма главным образом через стенку толстых кишок (у человека около 6-10 мг в сутки) и в незначительной степени почками.




Билет 6
Дата добавления: 2016-10-07; просмотров: 4569;











