Оксид сурьмы (III),
или сурьмянистый ангидрид, Sb2О3 — типичный амфотерный оксид с некоторым преобладанием основных свойств. В сильных кислотах, например серной и соляной, оксид сурьмы (III) растворяется с образованием солей сурьмы (III):
Sb203 + 3H2S04 = Sb2(S04)3 + 3H20.
Оксид сурьмы (III) растворяется также в щелочах с образованием солей сурьмянистой Н3 Sb О3 или метасурьмянистой HSb02 кислоты. Например:
Sb203 + 2NaOH = 2NaSb02 + Н20.
Сурьмянистая кислота, или гидроксид сурьмы (III), Sb(OH)3 получается в виде белого осадка при действии щелочей на соли сурьмы (III):
SbCl3 + 3NaOH = Sb(OH)3 + 3NaCl.
Осадок легко растворяется как в избытке щелочи, так и в кислотах.
Оксид Висмута
Последний член подгруппы — висмут — характеризуется преобладанием металлических свойств над неметаллическими и может рассматриваться как металл.
Оксид висмута (III) Вi203 образуется при прокаливании висмута на воздухе, а также при разложении нитрата висмута. Он имеет основной характер и растворяется в кислотах с образованием солей висмута (III).
Билет 3
2. Гидриды элементов VII группы.
Из соединений галогенов наиболее важное практическое значение имеют галогеноводороды и соли галогеноводородов.
Химическая связь в молекулах галогеноводородов — полярная ковалентная:общая электронная пара смещена к атому галогена как более электроотрицательному.
Прочность химической связи в молекулах галогеноводородов закономерно падает в ряду HF — НС1 — НВг — HI: это проявляется в изменении энтальпии диссоциации молекул на атомы.
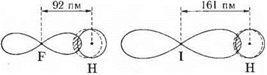 Схема перекрывания электронных облаков при образовании молекул HF и HI. Пунктиром условно показано смещение электронного облака атома водорода в сторону атома галогена.
Схема перекрывания электронных облаков при образовании молекул HF и HI. Пунктиром условно показано смещение электронного облака атома водорода в сторону атома галогена.
При переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее. С уменьшением прочности связи в молекулах галогеноводородов падает и их устойчивость к нагреванию. Термическая диссоциация фтороводорода происходит лишь при очень высоких температурах (более 3500 °С), тогда как йодоводород уже при 300 °С в значительной степени распадается на йод и водород:
2HI(г)  Н2(г) + 12(к), АН = -53,1 кДж.
Н2(г) + 12(к), АН = -53,1 кДж.
Все галогеноводороды — бесцветные газы с резким запахом.
Галогеноводороды очень хорошо растворимы в воде. При растворение галогеноводородов сопровождается их диссоциацией по кислотному типу, причем только фтороводород диссоциирован сравнительно слабо, остальные же принадлежат к числу наиболее сильных кислот.
В ряду HI — НВг — НС1 температуры кипения и плавления изменяются весьма закономерно (уменьшается), тогда как при переходе к HF они резко возрастают. Это обусловлено ассоциацией молекул фтороводорода в результате возникновения между ними водорсдных связей.
При растворении в воде молекулы фтороводорода диссоциируют с образованием ионов Н+ и F-. При этом частично разрываются водородные связи, так что диссоциация HF на ионы требует значительной затраты энергии. Поэтому фтороводород диссоциирует в водных растворах в значительно меньшей степени, чем другие галогеноводороды, по силе эта кислота лишь слегка превосходит уксусную.
Образовавшиеся при диссоциации HF ионы F- в значительной степени связываются с недиссоциированными молекулами HF, причем образуется ион HF2 , в котором атомы фтора связаны друг с другом водородной связью:
F- + HF  HF2-.
HF2-.
Поэтому при нейтрализации фтороводорода сначала образуются кислые соли, например, KHF2.
Отрицательные ионы галогеноводородов, за исключением фгорид-иона, обладают восстановительными свойствами, возрастающими по ряду Cl-, Br_, I-.
Хлорид-ион окисляется фтором, перманганатом калия, диоксидом марганца и другими сильными окислителями, например:
16НСl + 2КМn04 = 5С12 + 2КС1 + 2МnС12 + 8Н20.
Еще легче окисляются бромид и, в особенности, йодид-ионы. Последние также легко окисляются бромом, нитратами, солями Fe(III), например:
2FeCl3 + 2HI = 2FeCl2 +12 + 2НС1.
Поскольку галогенид-ионы обладают восстановительными свойствами, то при действии галогеноводородов на металлы последние могут окисляться лишь ионами водорода Н+. Поэтому галогеноводороды могут реагировать в растворе только с металлами, стандартный электродный потенциал которых меньше, чем у водорода.
Раствор фтороводорода в воде называется плавиковой кислотой. Это название происходит от плавикового шпата, из которого обычно получают фтороводород действием концентрированной серной кислоты:
CaF2 + H2S04 = CaS04 + 2HF.
Фтороводород реагирует с большинством металлов. Однако во многих случаях образующаяся соль малорастворима, вследствие чего на поверхности металла возникает защитная пленка. Так ведет себя, в частности, свинец, что и позволяет использовать его для изготовления аппаратуры, устойчивой к действию HF.
Замечательным свойством фтороводорода и плавиковой кислоты является их способность взаимодействовать с диоксидом кремния Si02, входящим в состав стекла; в результате образуется газообразный фторид кремния SiF4:
Si02 + 4HF = SiF4 + 2Н20.
В растворе плавиковой кислоты выделения фторида кремния не происходит, так как он взаимодействует с молекулами HF с образованием хорошо растворимой комплексной гексафторокремниевой (кремнефтороводородной) кислоты:
SiF4 + 2HF = H2[SiF6].
На взаимодействии HF с диоксидом кремния основано применение плавиковой кислоты для вытравливания на стекле различных меток, надписей и рисунков.
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Н2(г) + С12(Г) = 2НС1(Г), АН = —183,6 кДж.
Большие количества НС1 получают также в качестве побочного продукта хлорирования органических соединений согласно схеме
RH + С12 = RC1 + НС1,
где R — органический радикал.
Прежний «сульфатный» метод получения НС1, применяемый в настоящее время только в лабораторной практике, основан на взаимодействии NaCl и концентрированной H2SO4 согласно уравнениям:
NaCl + H2SO4 = NaHS04 + НС1;
NaCl + NaHS04 = Na2S04 + HC1.
Первая из этих реакций протекает в значительной степени уже при слабом нагревании; вторая осуществляется лишь при более высоких температурах. В качестве побочного продукта получается сульфат натрия Na2S04
Подобно другим сильным кислотам, НС1 энергично взаимодействует со многими металлами и оксидами металлов. Соли ее называются хлоридами. Большинство их хорошо растворимы в воде. Малорастворимы AgCl, РЬС12, CuCl, Hg2Cl2.
Бромоводород и йодоводород очень похожи по своим свойствам на хлороводород, но отличаются более выраженными восстановительными свойствами. Молекулярный кислород постепенно окисляет йодоводород уже при комнатной температуре, причем под действием света реакция сильно ускоряется:
4HI + 02 = 2I2 + 2Н20.
Бромоводород взаимодействует с кислородом гораздо медленнее, в то время как при обычных условиях соляная кислота вовсе с ним не взаимодействует.
Восстановительные свойства бромоводорода и йодоводорода заметно проявляются и при взаимодействии с концентрированной серной кислотой. При этом НВг восстанавливает H2S04 до S02:
2HBr + H2S04 = Br2 + S02 + 2Н20, a HI — до свободной серы или даже до H2S:
6HI + H2S04 = 3I2 + S + 4H20
или
8HI + H2S04 = 4I2 + H2S + 4H20.
Поэтому НВг трудно, a HI практически невозможно получить действием серной кислоты на бромиды или йодиды. Обычно эти галогеноводороды получают действием воды на соединения брома и йода с фосфором — РВг3 и PI3. Последние подвергаются при этом полному гидролизу, образуя фосфористую кислоту и соответствующий галогеноводород:
РВг3 + ЗН20 = Н3РО3 + ЗНВг ;
Р13 + ЗН20 = Н3РО3 + 3HI.
Раствор йодоводорода вплоть до 50%-ной концентрации можно получить, пропуская H2S в водную суспензию йода. Реакция идет согласно схеме:
I2 + H2S = Si + 2HI.
Билет 4
Дата добавления: 2016-10-07; просмотров: 3832;











