Сравнительная характеристика фтора и хлора.
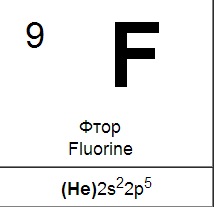
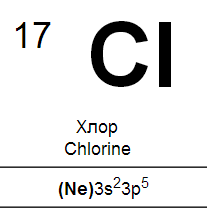
Входящие в главную подгруппу VII группы элементы фтор, хлор, бром, йод и астат называются галогенами. Это название, которое буквально означает «солерождающие», элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например хлорида натрия NaCl.
На внешней электронной оболочке атомов галогенов содержатся семь электронов — два на s- и пять на р-орбиталях (ns2np5). Галогены обладают значительным сродством к электрону. их атомы легко присоединяют электрон, образуя однозарядные отрицательные ионы, обладающие электронной структурой соответствующего благородного газа (ns2np6). Склонность к присоединению электронов характеризует галогены как типичные неметаллы. Аналогичное строение наружной электронной оболочки обусловливает большое сходство галогенов друг с другом, проявляющееся как в их химических свойствах, так и в типах и свойствах образуемых ими соединений. Но, как показывает сопоставление свойств галогенов, между ними имеются и существенные различия.
С повышением порядкового номера элементов в ряду F — At увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства и окислительная способность элементов.
В отличие от других галогенов, фтор в своих соединениях всегда находится в степени окисления —1, поскольку среди всех элементов он обладает самой высокой электроотрицательностью. Остальные галогены проявляют различные степени окисления от —1 до +7.
За исключением некоторых оксидов, которые будут рассмотрены ниже, все соединения галогенов соответствуют нечетным степеням окисления. Такая закономерность обусловлена возможностью последовательного возбуждения спаренных электронов в атомах Cl, Вг, I и At на d-подуровень, что приводит к увеличению числа электронов, принимающих участие в образовании ковалентных связей, до 3, 5 или 7.
Молекулы простых веществ, образуемых атомами галогенов, двухатомны. С увеличением в ряду F, Cl, Br, I, At радиуса атомов возрастает поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает возрастание температур плавления и кипения галогенов.
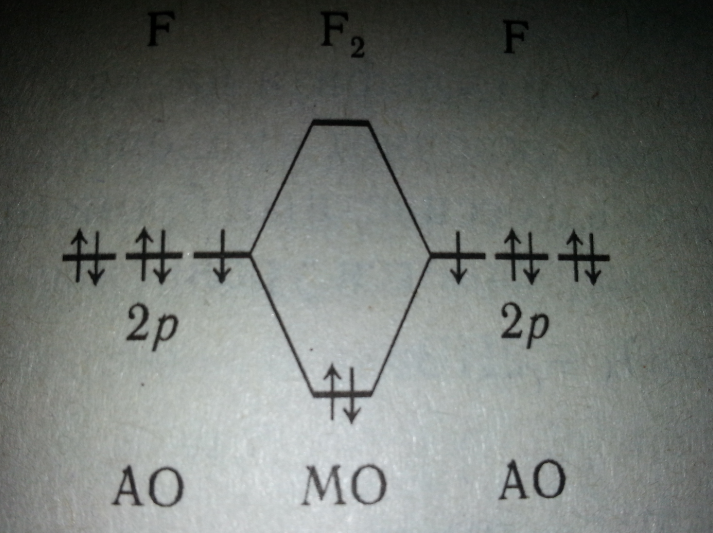
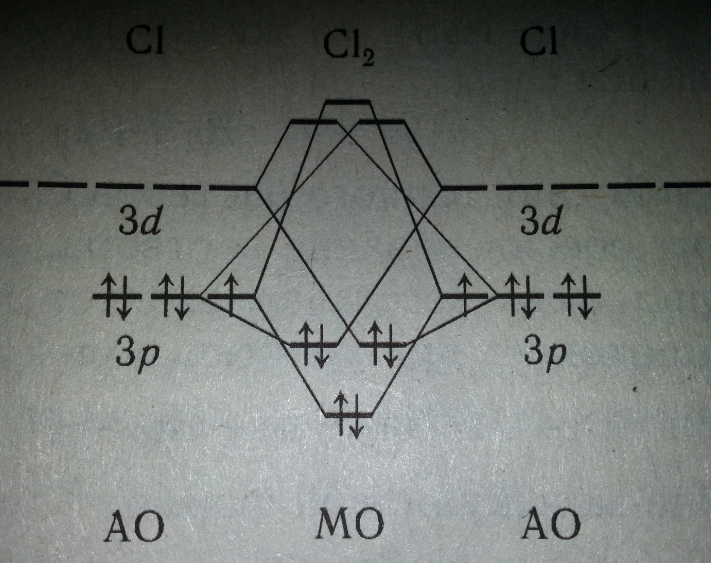
В ряду Сl2 — Вr2 —I2 прочность связи между атомами в молекуле постепенно уменьшается. Уменьшение прочности связи в молекулах галогенов проявляется в падении их устойчивости к нагреванию. Фтор выпадает из общей закономерности: прочность связи между атомами в его молекуле меньше, а степень термической диссоциации молекул выше, чем у хлора. Такие аномальные свойства фтора можно объяснить отсутствием d-подоболочки во внешней электронной оболочке его атома. В молекуле хлора и других галогенов есть свободные d-орбитали, и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь.
При образовании молекулы F2 понижение энергии электронов достигается за счет взаимодействия 2р-АО с неспаренными электронами атомов фтора (система 1 +1). Остальные p-АО неподеленных электронных пар можно считать не учавствующими в образовании химической связи. Химическая связь в молекуле Сl2, кроме аналогичного взаимодействия валентных Зр-АО атомов хлора (система 1+1), также образуется за счет взаимодействий Зр-АО неподеленной электронной пары одного атома хлора с вакантной 3d-АО другого (системы 2 +0). В результате порядок связи в молекуле С12 больше, чем в молекуле F2,а химическая связь — прочнее.
Галогены, вследствие их большой химической активности, находятся в природе исключительно в связанном состоянии — главным образом в виде солей галогеноводородных кислот.
Фтор встречается в природе чаще всего в виде минерала плавикового шпата СаF2.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl, который служит основным сырьем для получения других соединений хлора.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительные количества галогенов могут вызвать тяжелое отравление.
Галогены сравнительно мало растворимы в воде. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора. Раствор этот называется хлорной водой.
Фторне может быть растворен в воде, так как энергично разлагает ее:
2F2 + 2Н20 = 4HF + 02
Фтор и хлор со многими органическими растворителями интенсивно реагируют: сероуглероде, этиловом спирте, диэтиловом эфире, хлороформе, бензоле.
Химические свойства галогенов.
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами.
2Na + С12 = 2NaCl.
Медь, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Во всех этих случаях атомы металла отдают электроны, т. е. окисляются, а атомы галогенов присоединяют электроны, т. е. восстанавливаются. Эта способность присоединять электроны, резко выраженная у атомов галогенов, является их характерным химическим свойством. Следовательно, галогены — очень энергичные окислители.
Окислительные свойства галогенов проявляются также и при взаимодействии их со сложными веществами. Приведем несколько примеров.
1. При пропускании хлора через раствор хлорида железа (II) последний окисляется в хлорид железа (III), вследствие чего раствор из бледно-зеленого становится желтым:
2FeCl2 + С12 = 2FeCl3
Химическая активность фтора исключительно высока. Щелочные металлы, свинец, железо загораются в атмосфере фтора при комнатной температуре. На некоторые металлы (Al, Fe, Ni. Cu, Zn) фтор на холоде не действует, так как на их поверхности образуется защитный слой фторида. Однако при нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной.
Со многими неметаллами (водород, йод, бром, сера, фосфор, мышьяк, сурьма, углерод, кремний, бор) фтор взаимодействует на холоде: реакции протекают со взрывом или с образованием пламени:
Н2(г) + F2(г) = 2HF(г)
Si(K) + 2F2(r) = SiF4(r)
S(K) + 3F2(r) = SF6(r)
При нагревании с фтором соединяются хлор, криптон и ксенон, например: Хе(г) + F2tr) = XeF2(r)
Непосредственно фтор не реагирует только с кислородом, азотом и углеродом (в виде алмаза).
Очень энергично протекает взаимодействие фтора со сложными веществами. В его атмосфере горят такие устойчивые вещества, как стекло (в виде ваты) и водяной пар:
Si02(к) + 2F2(r) = SiF4(r) + 02(г)
2Н20(г) + 2F2(r) = 4HF(r) + 02(г)
Свободный хлор тоже проявляет очень высокую химическую активность, хотя и меньшую, чем фтор. Он непосредственно взаимодействует со всеми просты-ми веществами, за исключением кислорода, азота и благородных газов. Такие неметаллы, как фосфор, мышьяк, сурьма и кремний, уже при низкой темпера-туре реагируют с хлором; при этом выделяется большое количество теплоты. Энергично протекает взаимодействие хлора с активными металлами натрием, калием, магнием и др. При комнатной температуре без освещения хлор практически не взаимодействует с водородом, но при нагревании или на ярком солнечном свету реакция протекает по цепному механизму со взрывом.
Получение.
Фтор, вследствие своей высокой электроотрицательности, может быть выделен из соединений только путем электролиза (расплав состава KF+2HF подвергают электролизу. Электролиз ведут в никелевом сосуде, который является катодом, а анодом служит уголь).
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлоридов натрия или калия.
В лабораториях хлор получают действием различных окислителей на соляную кислоту.
Мn02 + 4НС1 = МnС12 + С12 + 2Н20 .
Соединения галогенов с водородом.
Химическая связь в молекулах галогеноводородов — полярная ковалентная: общая электронная пара смещена к атому галогена как более электроотрицательному. Прочность химической связи в молекулах галогеноводородов закономерно падает в ряду HF — НС1 — НВг — HI: это проявляется в изменении энтальпии диссоциации молекул на атомы.
При переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F — Cl — Br — I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах НС1, НВг и HI — все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами.
Галогеноводороды очень хорошо растворимы в воде. При 0 °С один объем воды растворяет около 500 объемов НС1, 600 объемов НВг и около 425 объемов HI (при 10 °С); фтороводород смешивается с водой в любых соотношениях.
Растворение галогеноводородов сопровождается их диссоциацией по кислот-ному типу, причем только фтороводород диссоциирован сравнительно слабо, остальные же принадлежат к числу наиболее сильных кислот.
Отрицательные ионы галогеноводородов, за исключением фгорид-иона, обладают восстановительными свойствами, возрастающими по ряду Cl-, Br_, I-.
Хлорид-ион окисляется фтором, перманганатом калия, диоксидом марганца и другими сильными окислителями, например:
16НС1 + 2КМп04 = 5С12 + 2КС1 + 2МnС12 + 8Н20.
Раствор фтороводорода в воде называется плавиковой кислотой. Это название происходит от плавикового шпата, из которого обычно получают фтороводород действием концентрированной серной кислоты:
CaF2 + H2S04 = CaS04 + 2HF.
Фтороводород реагирует с большинством металлов. Однако во многих случаях образующаяся соль малорастворима, вследствие чего на поверхности металла возникает защитная пленка.
Замечательным свойством фтороводорода и плавиковой кислоты является их способность взаимодействовать с диоксидом кремния Si02, входящим в состав стекла; в результате образуется газообразный фторид кремния SiF4:
Si02 + 4HF = SiF4 + 2Н20.
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является процесс синтеза его из водорода и хлора:
Н2(г) + С12(Г) = 2НС1(Г),
Большие количества НСl получают также в качестве побочного продукта хлорирования органических соединений согласно схеме
RH + С12 = RC1 + НС1,
Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии галогенов с кислородом, а только косвенным путем. Такие особенности кислородных соединений галогенов согласуются с тем, что почти все они характеризуются положительными значениями стандартной энергии Гиббса образования.
Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее - оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисления, достигающую семи.
Фторид кислорода OF2 можно получить пропусканием фтора в охлажденный 2%-ный раствор NaOH. Реакция идет согласно уравнению:
2F2 + 2NaOH = 2NaF + Н20 + OF2
Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с прцесса гидролиза хлора, т. е. с обратимой реакции между хлором и водой
С12(р) + Н20(Ж) <—>НС1(Р) + HClO(р)
в результате которой образуются соляная кислота и хлорноватистая кислота НОС1.
Билет 16
Химия водорода
Водород имеет три изотопа: протий 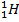 , дейтерий
, дейтерий 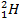 , или D, и тритий
, или D, и тритий 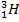 , или Т. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий — радиоактивен.
, или Т. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий — радиоактивен.
Молекула водорода состоит из двух атомов.
Водород в свободном состоянии встречается на Земле лишь в незначительных количествах. Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добывании нефти. Но в виде соединений водород весьма распространен.
В промышленности водород получают главным образом из природного газа. Этот газ, состоящий в основном из метана, смешивают с водяным паром и с кислородом. При нагревании смеси газов до 800—900° С в присутствии катализатора происходит реакция, которую схематически можно изобразить уравнением:
2СН4 + 02 + 2Н20 = 2С02 + 6Н2 .
В лабораториях водород получают большей частью электролизом водных растворов NaOH или КОН концентрация этих растворов выбирается такой, которая отвечает их максимальной электрической проводимости. Электроды обычно изготовляют из листового никеля. Этот металл не подвергается коррозии в растворах щелочей, даже будучи анодом. В случае надобности получающийся водород очищают от паров воды и от следов кислорода. Из других лабораторных методов наиболее распространен метод выделения водорода из растворов серной или соляной кислот действием на них цинка.
Свойства и применение водорода.
Водород — бесцветный газ, не имеющий запаха. В воде водород растворим очень мало, но в некоторых металлах, например в никеле, палладии, платине, растворяется в значительных количествах.
С растворимостью водорода в металлах связана его способность диффундировать через металлы. Кроме того, будучи самым легким газом, водород обладает наибольшей скоростью диффузии: его молекулы быстрее молекул всех других газов распространяются в среде другого вещества и проходят через разного рода перегородки. Особенно велика его способность к диффузии при повышенном давлении и высоких температурах.
Химические свойства водорода в значительной степени определяются способностью его атома отдавать единственный имеющийся у него электрон и превращаться в положительно заряженный ион. При этом проявляется особенность атома водорода, отличающая его от атомов всех других элементов: отсутствие промежуточных электронов между валентным электроном и ядром.
Ион водорода, образующийся в результате потери атомом водорода электрона, представляет собой протон, размер которого на несколько порядков меньше размера катионов всех других элементов. Поэтому поляризующее действие протона очень велико, вследствие чего водород не способен образовывать ионных соединений, в которых он выступал бы в качестве катиона. Его соединения даже с наиболее активными неметаллами, например с фтором, представляют собой вещества с полярной ковалентной связью.
Атом водорода способен не только отдавать, но и присоединять один электрон. При этом образуется отрицательно заряженный ион водорода с электронной оболочкой атома гелия. В виде таких ионов водород находится в соединениях с некоторыми активными металлами. Таким образом, водород имеет двойственную химическую природу проявляя как окислительную, так и восстановительную способность. В большинстве реакций он выступает в качестве восстановителя, образуя соединения, в которых степень его окисления равна +1. Но в реакциях с активными металлами он выступает в качестве окислителя: степень окисления его в соединениях с металлами равна —1.
Таким образом, отдавая один электрон, водород проявляет сходство с металлами первой группы периодической системы, а присоединяя электрон. — с неметаллами седьмой группы. Поэтому водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в скобках в первой.
Соединения водорода с металлами называются гидридами.
Гидриды щелочных и щелочноземельных металлов представляют собой соли. т. е. химическая связь между металлом и водородом в них ионная. При действии на них воды протекает окислительно-восстановительная реакция, в которой гидрид-ион Н- выступает в качестве восстановителя, а водород воды — в качестве окислителя:
Н- — е~ = Н0; Н20 + е-= Н° + ОН-.
В результате реакции образуются водород и основание. Например, гидрид кальция реагирует с водой согласно уравнению:
СаН2 + 2Н20 = 2H2 + Са(ОН)2 .
Если к струе водорода, выходящей из какого-нибудь узкого отверстия, поднести зажженную спичку, то водород загорается и горит несветящимся пламенем, образуя воду:
2Н2 + 02 = 2Н20.
При низких температурах водород с кислородом практически не взаимодействуют. Если смешать оба газа и оставить смесь, то и через несколько лет в ней нельзя обнаружить даже признаков воды.
Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Молекулы водорода и кислорода очень прочны; подавляющее большинство столкновений между ними при комнатной температуре оказываются неэффективными. Лишь при повышенных температурах, когда кинетическая энергия сталкивающихся молекул делается большой, некоторые соударения молекул становятся эффективными и приводят к образованию активных центров.
При высокой температуре водород может отнимать кислород от многих соединений, в том числе от большинства оксидов металлов. Например, если пропускать водород над накаленным оксидом меди, то происходит восстановление меди:
СиО + Н2 = Сu + Н20.
Атомарный водород: При высокой температуре молекулы водорода диссоциируют на атомы:
Н2 <=> 2Н.
Осуществить эту реакцию можно, например, раскаляя током вольфрамовую проволочку в атмосфере сильно разреженного водорода. Реакция обратима, и чем выше температура, тем сильнее равновесие сдвинуто вправо.
Атомарный водород получается также при действии тихого электрического разряда на молекулярный водород, находящийся под давлением около 70 Па. Образующиеся при этих условиях атомы водорода не сразу соединяются в молекулы, что дает возможность изучить их свойства.
При разложении водорода на атомы поглощается большое количество теплоты:
Н2(г) = 2Н(Г)
Отсюда понятно, что атомы водорода должны быть гораздо активнее его молекул. Чтобы молекулярный водород вступил в какую-либо реакцию, молекулы должны распасться на атомы, для чего необходимо затратить большое количество энергии. При реакциях же атомарного водорода такой затраты энергии не требуется.
Действительно, атомарный водород уже при комнатной температуре восстанавливает многие оксиды металлов, непосредственно соединяется с серой, азотом и фосфором; с кислородом он образует пероксид водорода.
Пероксид водорода.
Пероксид (перекись) водорода представляет собой бесцветную сиропообразную жидкость. Это очень непрочное вещество, способное разлагаться со взрывом на воду и кислород, причем выделяется большое количество теплоты:
2Н202(Ж) — 2Н2О(ж) + 02(Г)
Водные растворы пероксида водорода более устойчивы; в прохладном месте они могут сохраняться довольно долго.
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород. Однако если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода.
Пероксид водорода получается также при действии атомарного водорода на кислород.
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой: Н — О-О — Н.
Молекулы Н202 обладают значительной полярностью, что является следствием их пространственной структуры.
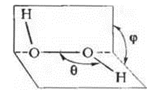
С некоторыми основаниями пероксид водорода реагирует непосредственно, образуя соли. Так, при действии пероксида водорода на водный раствор гидроксида бария выпадает осадок бариевой соли пероксида водорода:
Ва(ОН)2 + Н202 = Ва02 + 2Н20 .
Соли пероксида водорода называются пероксидами или перекисями. Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов О2-. Степень окисления кислорода в пероксиде водорода равна — 1, поэтому пероксид водорода обладает свойствами как окислителя, так и восстановителя, т. е. проявляет окислительно -восстановительную двойственность. Все же для него более характерны окислительные свойства, так как стандартный потенциал электрохимической системы
Н202 + 2Н+ + 2е~ = 2Н20,
В качестве примеров реакций, в которых Н202 служит окислителем, можно привести окисление нитрита калия
KNO2 + Н202 = KN03 + H2O
и выделение йода из йодида калия:
2KI + Н202 = I2 + 2КОН.
Как пример восстановительной способности пероксида водорода укажем на реакции взаимодействия Н202 с оксидом серебра (I)
Ag20 + Н202 = 2Ag + Н20 + 02 ,
Дата добавления: 2016-10-07; просмотров: 16401;











