Химическое равновесие
Химическая кинетика изучает скорость и механизм химических процессов, а также зависимость их от различных факторов – природы реагирующих веществ, их концентрации, температуры, наличия катализаторов и других параметров.
Истинная скорость реакции в данный момент представляет собой изменение концентрации за бесконечно малый промежуток времени, т.е. первую производную концентрации по времени:
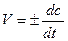
Концентрации реагирующих веществ выражаются в моль/л, следовательно, размерность скорости реакции - моль/л*сек.
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, присутствия катализаторов. Для реакции с участием твёрдых веществ скорость реакции зависит также и от степени дисперсности, развития поверхности раздела фаз, а для газов от давления.
Скорость реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентрации реагирующих веществ, возведённых в степени их стехиометрических коэффициентов, если реакция идёт в одну стадию.
Для реакции, идущей в одну стадию: mA + nB = pC + qД основной закон кинетики имеет следующее математическое выражение:
V = kCAm * CBn , или V = k [A]m * [B]n ,
где V – скорость химической реакции;
k – константа скорости;
СА и СВ – концентрации реагирующих веществ;
[А] и [В] – равновесные концентрации веществ;
m и n – стехиометрические коэффициенты реагирующих веществ.
Константа скорости реакции зависит от природы реагирующих веществ, температуры, но не зависит от концентрации. Она численно равна скорости реакции, когда концентрации реагирующих веществ или их произведение равны единице.
Скорость химической реакции зависит от температуры, увеличиваясь при её повышении. Эта зависимость приближённо описывается правилом Вант-Гоффа: при повышении температуры на каждые 10° константа скорости увеличивается в 2 – 4 раза. Математически эта зависимость определяется соотношением:
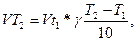
где VT1 - скорость реакции при начальной температуре Т1;
VT2 – скорость при конечной температуре;
γ – температурный коэффициент скорости реакции.
Температурный коэффициент скорости реакции γ показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10°С:
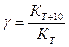 ,
,
где Кт – константа скорости при температуре Т;
КТ + 10 – константа скорости при температуре Т + 10.
Катализом называют изменение скорости реакции, происходящее под действием катализаторов. Катализаторы участвуют в процессе, а к концу реакции остаются практически неизменными.
В каталитических реакциях катализатор только ускоряет или замедляет реакцию, но не влияет на глубину её протекания и константу равновесия (в равной степени воздействует как на прямую, так и на обратную реакцию).
Ускоряющая роль катализатора обусловлена образованием промежуточных переходных комплексов хотя бы одного из реагирующих веществ с катализатором. Образование этих переходных комплексов с катализатором приводит к снижению энергии активации реакции, а значит, к её ускорению. Катализ подчиняется основному кинетическому закону, т.е. скорость каталитической реакции пропорциональна концентрации катализатора (для гомогенного катализа).
В зависимости от природы реагирующих веществ для ускорения их взаимодействия подбирают вещество-катализатор. Катализаторы и катализ являются, поэтому избирательными, или «селективными».
Катализ может быть положительным и отрицательным, в зависимости от направления влияния катализатора. При этом отрицательные катализаторы (вещества, которые уменьшают скорость реакции) носят название ингибиторов. Существуют вещества увеличивающие активность катализатора – промоторы (Na2SO4 для As2O5), а также подавляющие её – каталитические яды (HCN; As2O3 и др.).
Дата добавления: 2016-09-06; просмотров: 1532;











