Экспериментальная часть
Задание 1. Пользуясь данными, приведенными в приложении (табл. 1), построить график зависимости плотности раствора хлорида натрия от массовой доли хлорида натрия. Рекомендуется принять масштаб: по оси абсцисс— массовая доля (2 см соответствует 1%), по оси ординат— плотность (2 см соответствуют 0,01 г/мл).
Задание 2. Приготовить 250 мл раствора хлорида натрия с заданной массовой долей растворённого вещества (массовая доля задаётся преподавателем).
1. РАСЧЁТ КОЛИЧЕСТВА КОМПОНЕНТОВ
Вначале следует рассчитать количество исходных компонентов— соли и воды, необходимое для приготовления нужного количества раствора.
Пример: приготовить 300 мл раствора хлорида натрия с содержанием массовой доли растворенного вещества равной 5%.
1. По таблице (табл. 1 приложения) найти плотность раствора с массовой долей 5%, ρ = 1,034 г/мл.
2. Определить массу соли NаС1 в этом растворе, используя формулу (2).
C * V * ρ 5 * 300 * 1,034

 m = 100 = 100 = 15,51 г.
m = 100 = 100 = 15,51 г.
3. Определить массу воды: mр-ра — mв-ва = Vр.ра * ρ — mв-ва .
Подставить значения в формулу:
300 * 1,034—15,51 = 310,2—15,51 = 294,69 г
2. ПРИГОТОВЛЕНИЕ РАСТВОРА ХЛОРИДА НАТРИЯ
Взвесить на технических весах с точностью до 0,01 г часовое стекло. Затем поместить на него сухую соль в количестве, примерно равном расчётному. Взвесить часовое стекло с солью с точностью до 0,01 г и подсчитать массу соли.
Рассчитать, исходя из массы соли, необходимое количество воды и отмерить его мерным цилиндром.
В плоскодонную колбу через воронку перенести навеску соли. Часовое стекло над воронкой обмыть небольшим количеством дистиллированной воды, отмеренной для растворения. Оставшееся количество отмеренной воды вылить небольшими порциями так, чтобы всю соль с воронки смыть в колбу. Для ускорения растворения раствор осторожно перемешать стеклянной палочкой.
3. ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ NaCl В ПОЛУЧЕННОМ РАСТВОРЕ
Для определения массовой доли растворенного вещества в полученном растворе необходимо измерять его плотность ареометром. Приготовленный раствор перелить в цилиндр на 250 мл и осторожно погрузить в него ареометр. Опускать его из рук следует только после того, как вы убедитесь, что ареометр плавает в растворе. При этом необходимо следить за тем, чтобы ареометр не касался стенок цилиндра. Добившись такого положения, нужно сделать отсчёт плотности с точностью до третьего знака. Затем, пользуясь составленным графиком зависимости плотности раствора от массовой доли, найти массовую долю растворённого вещества, соответствующую измеренной плотности.
Рассчитав массовую долю (она должна отличаться не более чем на 3% от заданной преподавателем), следует рассчитать концентрации: молярную, моляльную и титр по формулам 3, 4, 5. Все полученные результаты необходимо свести в таблицу (см. табл. ).
Таблица №
| Заданная массовая доля, % | Плотность, г/см3, ρ (по табл.) | Количество компонентов, г | Плотность, ρ, г/см3, фактич. | Массовая доля, %, фактич. | Молярность, моль/ 1000 мл | Моляль- ность, моль/ 1000 г | Титр, г/мл | |
| вода | соль | |||||||
Расчёт относительной ошибки, К:
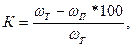
где ωт – массовая доля соли в растворе, заданная преподавателем;
ωп – массовая доля соли в растворе, определённая студентом.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Что такое растворы?
2.Что такое растворимость? Какая существует зависимость между изменением температуры и растворимостью твёрдых тел?
3.Что такое перенасыщенные растворы? Как их готовят?
4.Что такое кристаллизация? Её практическое значение?
5.Какая зависимость существует между плотностью раствора и содержанием массовой доли растворённого вещества?
6.В чём отличие концентрированных и разбавленных растворов?
7.Какие способы выражения концентрации вы знаете?
8.Какая связь между молярностью и содержанием массовой доли растворённого вещества?
Задания для самостоятельной работы по теме
«Способы выражения концентрации растворов»
1.Вычислить молярность, нормальность, титр раствора вещества А с массовой долей ω и плотностью ρ.
| № варианта | А | ω, % | ρ, г/мл | № варианта | А | ω, % | ρ, г/мл | |
| НС1 | 1.10 | H2SO4 | 1.29 | |||||
| H2SO4 | 1.52 | КОН | 1.10 | |||||
| NaOH | 1.11 | NH4C1 | 1.06 | |||||
| CH3COOH | 1.07 | CuC12 | 1.20 | |||||
| NaOH | 1.56 | HNO3 | 1.32 | |||||
| НС1 | 1.19 | H3PO4 | 1.03 | |||||
| H3PO4 | 1.10 | Na2CO3 | 1.19 | |||||
| H2SO4 | 1.14 | NaC1 | 1.09 | |||||
| NH4OH | 0.91 | FeSO4 | 1.21 | |||||
| КС1 | 1.05 | CuSO4 | 1.18 | |||||
| КОН | 1.13 | ZnC12 | 1.19 | |||||
| НС1 | 1.05 | KNO3 | 1.60 | |||||
| КОН | 1.29 | K2CO3 | 1.105 | |||||
| H2SO4 | 1.15 | HNO3 | 1.22 | |||||
| HNO3 | 1.10 | NaC1 | 1.50 |
2.До какого объёма нужно разбавить V мл раствора вещества А с массовой долей ω и плотностью ρ, чтобы получить раствор с концентрацией С? Какова масса растворённого вещества в 100 мл полученного раствора?
| № варианта | А | V | ω | ρ | C | № варианта | А | V | ω | ρ | C | |
| Na2CO3 | 1.10 | 0.5н | H3PO4 | 1,10 | 2н | |||||||
| FeC13 | 1,13 | 1,0н | NaOH | 1,56 | 9М | |||||||
| H2SO4 | 1,84 | 5н | НС1 | 1,19 | 6,5М | |||||||
| HNO3 | 1,22 | 3,5М | H2SO4 | 1,52 | 4,5н | |||||||
| NaC1 | 1,50 | 2,5М | КОН | 1,29 | 5н | |||||||
| FeC12 | 1,10 | 0,3н | HNO3 | 1,32 | 2,5М | |||||||
| H2SO4 | 1,105 | 0,8н | Na2CO3 | 1,19 | 3,8н | |||||||
| ZnC12 | 1,19 | 1,25н | NaC1 | 1,10 | 1,2М | |||||||
| H2SO4 | 1,50 | 7н | КС1 | 1,08 | 1,4н | |||||||
| NaOH | 1,25 | 4н | H2SO4 | 1,08 | 6,3н | |||||||
| HNO3 | 1,40 | 2н | FeSO4 | 1,21 | 1,2н | |||||||
| CuC12 | 1,20 | 1,5н | NaOH | 1,22 | 5,0М | |||||||
| NH4C1 | 1,06 | 3,0М | NaC1 | 1,07 | 1,6М | |||||||
| КОН | 1,41 | 8М | Na2CO3 | 1,15 | 2,2М | |||||||
| H2SO4 | 1,29 | 6н | КОН | 1,17 | 2,8н |
Дата добавления: 2016-09-06; просмотров: 2001;











