Экспериментальная часть
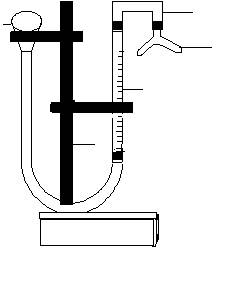
1. Определение металла проводят в приборе, изображённом на рис.1.
 3
3
2 Рис. 1. Прибор для определения эквивалента металла
4 .
1 – бюретка на 50 мл;
1 2 – воронка;
3 – газоотводная трубка;
4 – сосуд Ландойля (двухколенная пробирка);
5 5 – штатив.
С помощью цилиндра и воронки налейте в одно колено сосуда Ландойля, не касаясь стенок, 10 мл раствора соляной кислоты с массовой долей НСl 10%. В другое колено пробирки осторожно опустите навеску металла.
2. Присоедините сосуд к прибору. Убедитесь в герметичности прибора, подняв воронку вместе с кольцом на 10 – 15 см. Если уровень воды в бюретке не меняется, то прибор герметичен, и можно приступить к опыту. Если уровень воды в бюретке меняется, то необходимо плотнее присоединить сосуд, снова проверить и т.д. до тех пор, пока не будет достигнута герметичность прибора (в случае необходимости следует обратиться за помощью к лаборанту или преподавателю). После проверки герметичности верните воронку в первоначальное положение. Установите воду в бюретке и воронке на одном уровне. Уровень воды в бюретке (V1) до начала опыта запишите с точностью 0,1 мл. Приведите в контакт кислоту и металл, осторожно наклоняя сосуд Ландойля таким образом, чтобы кислота перелилась в то колено, где находится металл.
 3. После полного растворения металла, протекающего по уравнению реакции Ме+2НCl = МеCl2 + H2 , дайте охладиться сосуду до комнатной температуры в течение 5 – 7 минут.
3. После полного растворения металла, протекающего по уравнению реакции Ме+2НCl = МеCl2 + H2 , дайте охладиться сосуду до комнатной температуры в течение 5 – 7 минут.
4. Установите воду в бюретке и воронке на одном уровне. При этом внутри прибора создаётся давление, равное атмосферному. Запишите уровень воды V2 в бюретке после опыта и высчитайте объём выделившегося водорода по разности уровней воды V2 - V1.
5. Отметьте атмосферное давление, температуру воздуха в лаборатории и по таблице 1 (см. приложение) найдите давление водяного пара h. Поправку на h вводят вследствие того, что общее давление на воду является суммой парциальных давлений водорода и паров воды.
6. По завершении эксперимента не забудьте вылить содержимое сосуда Ландойля в сливную банку и промыть водой.
7. Запишите и сделайте расчёт.
ФОРМА ЗАПИСИ И РАСЧЁТ
Навеска металла, г…………………………………………………..…….m
Объём выделившегося водорода, мл……………………………….…....V
а) уровень воды в бюретке до опыта ……………………………….… V1
б) уровень воды в бюретке после опыта……………………………….V2
Температура воздуха в лаборатории, Кº................................................T
Атмосферное давление, кПа…………………………………………….....P
Давление насыщенного водяного пара при температуре опыта
(см. табл. 2 приложения), кПа ........................................................................… h
Объём выделившегося водорода при нормальных условиях:
V * (P – h) * 273
 V0 =
V0 =
101,325 * T
Эквивалент металла определяем по объёму выделившегося водорода.
Эквивалент металла вытесняет объём водорода, соответствующий его молярной массе эквивалента, т.е. 11200 мл. Составляем пропорцию:
ЭМе ………………… 11200 мл
mМе ………………… V0
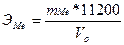
8. Рассчитайте, какой металл был предложен для проведения опыта, если его валентность равна 2.
9. Вычислите величину относительной ошибки в процентах:
 (Этеор. – Ээкспер.) * 100
(Этеор. – Ээкспер.) * 100
К% = Этеор.
ВОПРОСЫ И УПРАЖНЕНИЯ.
1. Сформулируйте закон эквивалентов.
2. Как определяется эквивалент элемента и эквиваленты сложных веществ (оксида, гидроксида, кислоты, соли)?
3. Что такое молярная масса и молярный объём эквивалента?
4. Рассчитайте молярные массы эквивалента серы в соединениях: H2S; SO2; H2SO4; Cr2(SO4)3.
5. Вычислите молярные массы эквивалентов следующих сложных веществ: Al2O3; HCl; NaOH; H2SO4; Ca(OH)2; Al2(SO4)3.
Задания для самостоятельной работы по теме:
”Классы неорганических соединений. Основные законы химии”
Вариант № 1
1. Соединение металла с галогенами содержит 64,65% галогена, оксид этого же металла содержит 15,4% кислорода. Определить молярную массу эквивалента галогена.
2. 1л воздуха (н.у.), содержащего сероводород, пропустили через раствор йода. В результате количество йода в растворе уменьшилось на 0,0254 г. Каково процентное содержание сероводорода в воздухе?
3. В соединении 52,9% Al и 47,1% О (кислорода) молекулярная масса соединения 102. Какова истинная формула соединения?
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионной формах.



 Al Al2O3 AlCl3 AlOHCl2 Al(OH)2Cl
Al Al2O3 AlCl3 AlOHCl2 Al(OH)2Cl
Вариант № 2
1. Вычислить молярную массу эквивалента кислоты, основания и соли в реакции:
2Н3РО4 + Са(ОН)2 = Са(Н2РО4)2 + 2Н2О
2. Барий получают алюминотермическим восстановлением оксида бария. Какая масса бария будет получена при взаимодействии оксидного концентрата массой 600г (массовая доля ВаО 91,8%) с техническим алюминием массой 100г (массовая доля алюминия 98,55%).
3. Вывести простейшую формулу оксида ванадия, зная, что 2,73г оксида содержат 1,53г металла.
4. Осуществить следующие превращения. Составить ионные уравнения реакций (полные и сокращённые):
 Pb(NO3)2 PbO PbCl2 PbOHCl Pb(OH)2
Pb(NO3)2 PbO PbCl2 PbOHCl Pb(OH)2
Вариант № 3
1. Какое количество оксида получится при окислении 1г металла, молярная масса эквивалента которого 23 г/моль.
2. Имеется смесь карбоната натрия и гидрокарбоната натрия. При прокаливании образца смеси массой 60 г выделилась вода массой 2,7 г. Определить процентный состав смеси.
3. Вывести простейшую формулу вещества, состоящего из 1,19% водорода, 41,67% хлора, 57,14% кислорода.
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионной форме:
СаСО3 → СО2 → Н2СО3 → КНСО3 → ВаСО3
Вариант № 4
1. Какой объём водорода выделится при взаимодействии 0,34 г металла с кислотой, молярная масса эквивалента которого равна 20г/моль.
2. Аммиак массой 85 кг был пропущен через азотную кислоту массой 330 кг (считая на чистую). Какова масса полученного нитрата аммония?
3. Массовые доли водорода, фосфора и кислорода в некоторой кислоте равны соответственно 3,66, 37,8 и 58,54%. Определите простейшую формулу кислоты.
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионной формах:
As2O3 → Na2HAsO4 → Na3AsO4 → Na2SO4 → NaHSO4
Вариант №5
1. Определить молярную массу эквивалента сурьмы, если в реакцию с 1,525 г сурьмы вступил 1 г серы. Молярная масса эквивалента серы равна 16 г/моль.
2. При взаимодействии соляной кислоты с 1,2 г сплава железо-медь выделилось 112 мл водорода при н.у. Вычислить процентный состав сплава.
3. Массовая доля олова и хлора равны соответственно 62,6 и 37,4%. Определите простейшую формулу хлорида.
4. Осуществить следующие превращения. Записать полные и сокращённые ионные уравнения реакций:
Р2О5 → КН2РО4 → К2НРО4→ К3РО4 → Са3(РО4)2
Вариант №6
1. На нейтрализацию 2 г основания израсходовано 4,28 г соляной кислоты. Вычислить молярную массу эквивалента основания.
2. Образец смеси оксида меди с углеродом массой 56 г прокалили. При этом образовалась чистая медь массой 12 г. Определить процентный состав смеси.
3. Массовые доли элементов в минерале изумруда равны 5,06% Ве, 10,05% Аl, 32,49% Si, 53,40% O. Определите формулу минерала и представьте её в виде соединения оксидов металлов.
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионной формах:
MgOHCl → MgCl2 → Mg(OH)2 → MgO → Mg → MgSO4
Вариант №7
1. Определить молярную массу эквивалента вещества (ZnOH)2SO4 в реакции: (ZnOH)2SO4 + H2SO4 → 2ZnSO4 + 2H2O.
2. Оксид кальция массой 28 г обработали азотной кислотой массой 100 г. Найти массу полученного нитрата.
3. Соединение мышьяка с водородом содержит 3,58% Н. Найти простейшую формулу вещества.
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионных формах:
KCl → KHSO4 → K2SO4 → KNO3 → HNO3
Вариант № 8
1. Определить молярную массу эквивалента вещества Cr(OH)2NO3 в реакции: Cr(OH)2NO3 + 2НNO3 → Cr(NO3)2 + 2Н2О.
2. Через раствор, содержащий 5г едкого натра, пропустили 6,5л сероводорода (н.у.). Какая соль и в каком количестве образовалась?
3. Вывести простейшую формулу кристаллогидрата, если после прокаливания 2,03г его получилось 0,95г MgCl2.
4. Осуществить следующие превращения. Записать уравнения реакций в ионной форме (полной и сокращённой):
Al2O3 → Al2(SO4)3 → Al(ОH)3 → AlOHCl2 → Al(ОH)3
Вариант № 9
1. Определить молярную массу эквивалента металла, если соединение металла с йодом содержит 94,8% йода. Молярная масса эквивалента йода равна 127г/моль.
2. При растворении в водном растворе щёлочи 80г смеси кремния с цинком выделилось 6,272л газа (н.у.). Найдите процентный состав смеси.
3. Вывести формулу спирта, если количественный состав его характеризуется отношением m(С) : m(Н) : m(О) = 3 : 1 : 4.
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионной формах:
Са(ОН)2→ СаСО3 → Са(НСО3)2→ СаСО3 → СaСl2
Вариант № 10
1. Вычислить массу марганца в его оксиде, где на 1г марганца приходится 1,02г кислорода.
2. Определить содержание карбоната калия и гидроксида калия в смеси (в %), если при действии избытка серной кислоты на эту соль выделилось 4,48л (н.у.) газа и образовалось 10,8г воды.
3. Определить формулу гидроксида железа, если известны массовые доли составляющих его элементов: 62,2% железа, 35,6% кислорода, 2,2% водорода?
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионной формах:
Cr2(SO4)3 → Cr(OH)3 → NaCrO2 → СrCl3 → Cr
Вариант №11
1. Вычислить молекулярную массу эквивалента кислоты, соли и основания в реакции:
Н3РО4 + 3Са(ОН)2 = (СаОН)3РО4 + 3Н2О.
2. Какова масса свободной меди, получающейся из оксида меди (II) массой 20г при восстановлении его оксидом углерода (II) массой 8,4г.
3. Вывести простейшую формулу минерала, содержащего 34,6% меди, 30,4% железа и 35,0% серы.
4. Осуществить следующие превращения. Записать уравнения реакций в ионной форме (полной и сокращённой):
Si → SiO2 → K2SiO3 → H2SiO3 → Ca(HSiO3)2 → CaO
Вариант № 12
1. В каком количестве NаОН содержится столько же эквивалентных масс, сколько в 140г КОН?
2. При прокаливании смеси хлората калия КClО3 и хлорида калия массой 50г выделился газ объёмом 6,72л (н.у.). Определить массовую долю КСl в исходной смеси солей.
3. Найти простейшую формулу вещества, в состав которого входит водород, углерод, кислород в соотношении 1 : 3 : 4.
4. Записать уравнения реакций в полной и сокращённой ионной формах:
MgСО3 → Mg(OH)2 → MgO → MgСl2 → MgOHCl
Вариант № 13
1.Вычислить молярную массу эквивалента СО2 в реакции:
CO2 + NaOH → NaHCO3
2. Определить массу гидроксида бария, полученного при взаимодействии воды массой 50г и оксида бария массой 1,2г.
3. Вывести простейшую формулу вещества, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
4. Осуществить следующие превращения. Записать уравнения реакций в полной и сокращённой ионных формах:
К2О → KOH → Cu(OH)2 → CuOHNO3 → Cu(NO3)2
Вариант № 14
1. Определить молярные массы окислительно-восстановительных эквивалентов веществ в процессах:
а) Fe2O3 → Fe ; б) KClO3 → КCl.
2. Определить массу ортофосфорной кислоты, получающейся при взаимодействии 105кг ортофосфата кальция со 150кг серной кислоты.
3. В карбиде железа массовая доля углерода составила 6,67%. Определите формулу карбида железа.
4. Осуществить следующие превращения. Уравнения реакций записать в полной и сокращённой ионной формах:
NH4HCO3 → NH3 → (NH4)HSO4 → NH4OH → NH4NO3 → NH3
Вариант № 15
1. Определить молярную массу эквивалента NaHSO3 в реакции:
NaHSO3 + NaOH = Na2SO3 + H2O
2. Для получения азотной кислоты в лаборатории взяли нитрат натрия массой 17г и чистую серную кислоту массой 20г. Какова масса получившейся азотной кислоты? Какое вещество и в каком количестве осталось после реакции?
3. Вывести простейшую формулу вещества, содержащего 1% водорода, 35% хлора, 64% кислорода.
4. Осуществить следующие превращения. Составить ионные уравнения реакции (полные и сокращённые):
FeCl3 → Fe(OH)3 → Fe2O3 → Fe → Fe(NO3)3
Вариант № 16
1. Определить окислительно-восстановительные молярные массы эквивалентов веществ, участвующих в реакции:
AsH3 + O2 = As2O3 + H2O
2. К раствору, содержащему хлорид кальция массой 4,5г, прилили раствор, содержащий фосфат натрия массой 4,1г. Определить массу полученного осадка, если выход продукта составляет 83%.
3. Найти простейшую формулу вещества, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
4. Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием соли на соль.
Вариант № 17
1. Вычислить молярную массу эквивалента серы в соединении её с железом, зная, что в этом соединении 1г серы соединяется с 1,73г железа, молярная масса эквивалента которого 28г/моль.
2. Смесь солей нитрата калия и хлорида калия массой 5г обработали нитратом серебра. При этом получилось 1,5г осадка. Определить процентный состав исходной смеси.
3. Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1 : 3 : 4 : 7.
4. Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Вариант № 18
1. Определить молярные массы эквивалентов окислителя и восстановителя в реакции:
SO2 + Br2 + 2H2O = 2HBr + H2SO4
2. Смешаны два раствора, содержащие 8,55г Ва(ОН)2 и 3,75г НСl. Какое вещество и в каком количестве останется после реакции? Сколько граммов ВаСl2 образуется?
3. Найти простейшую формулу оксида ванадия, зная, что 2,73г оксида содержат 1,53г металла.
4. Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Вариант № 19
1. Рассчитать молярную массу эквивалента FeCl3 в реакции:
FeCl3 + 2КОН = Fe(ОН)2Cl + 2КCl
2. При обработке раствором гидроксида натрия 3,9г смеси алюминия с его оксидом выделилось 840мл газа (при н.у.). Определить процентное содержание оксида алюминия в смеси.
3. Вещество содержит 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу.
4. Составить формулы нормальных и кислых солей калия и кальция, образованных: а) угольной кислотой; б) мышьяковистой кислотой.
Вариант № 20
1. Определить окислительно-восстановительные молярные массы эквивалентов веществ, участвующих в реакции:
AgNO3 + AsH3 + H2O → Ag + H3AsO4 + HNO3
2. Какова масса силиката кальция, полученного при сплавлении карбоната кальция массой 25г с оксидом кремния (IV) массой 10г?
3. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6г соли при прокаливании теряют в массе 5,4г.
4. Назвать соли: SbONO3, [Fe(OH)2]2CrO4, (AlOH)SO4, Cd(HS)2, Ca(H2PO4)2.
Вариант № 21
1. Определить окислительно-восстановительные молярные массы эквивалентов веществ, участвующих в процессах:
а) H2SO4 → H2S б) МnО2 → MnСl2
2. Смесь хлорида аммония массой 10,7г с гидроксидом кальция массой 8г нагрели для получения аммиака. Найдите массу полученного аммиака.
3. Найти молекулярную формулу вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
4. При взаимодействии каких веществ можно получить дигидроортоантимонат натрия, метахромит натрия, гидроортоарсенат калия, сульфат гидроксоалюминия? Составить уравнения реакций.
Вариант № 22
1. На нейтрализацию 2г кислоты израсходовано 2,94г КОН. Вычислить молярную массу эквивалента кислоты.
2. Определите количественный состав смеси, состоящий из кальция и оксида кальция, если при нагревании этой смеси с углеродом выделилось 4,48г газа (н.у.) и образовалось 19,2г продукта реакции.
3. Найти молекулярную формулу масляной кислоты, содержащей 54,5% углерода, 36,4% кислорода и 9,1% водорода, зная, что плотность её паров по водороду равна 44.
4. Написать уравнения реакций образования Mg2P2O7, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результате взаимодействия:
а) основного и кислотного оксидов;
б) основания и кислотного оксида;
в) основного оксида и кислоты;
г) основания и кислоты.
Вариант № 23
1. 2г двухвалентного металла вытесняют 1,842л водорода (н.у.). Вычислить молярную массу эквивалента металла.
2. Имеется 20л смеси оксида углерода (II) и оксида углерода (IV). При пропускании этой смеси через раствор гидроксида калия объём газа уменьшился до 16л. Определить процентный состав смеси.
3. При сгорании 4,3г углеводорода образовалось 13,2г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
4. Написать уравнения реакций, с помощью которых можно получить в лаборатории следующие вещества: а) хлороводород; б) сульфид свинца; в) сульфат бария; г) ортофосфат серебра; д) гидроксид железа (III); е) нитрат меди (II).
Вариант № 24
1. Определить окислительно-восстановительные молярные массы эквивалентов веществ, участвующих в реакции:
KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O
2. К раствору, содержащему 1,96г фосфорной кислоты, прибавить раствор, содержащий 2,8г едкого калия. Какая соль и в каком количестве образовалась при этом?
3. При взрыве смеси, полученной из одного объёма некоторого газа и двух объёмов кислорода, образуются два объёма СО2 и один объём N2. Найти формулу газа.
4. Назвать соли: а) Zn(NO3)2; б) NaH2SbO4; в) К2Н2Р2О7; г) Al(OH)2NO3; д) СаCrO4; е) K3AsO4; ж) Na2Cr2O7; з) Ва(НSO3)2; и) CrOHSO4; к) (СаОН)2СО3; л) NaHS.
Вариант № 25
1. Определить окислительно-восстановительные молярные массы эквивалентов, участвующих в реакции:
KI + (NH4)2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3+ K2SO4 + (NH4)2SO4 + H2O
2. В закрытом сосуде смешаны оксиды азота (II) массой 15г и кислород массой 10г. Какова масса получившегося оксида? Сколько и какого газа осталось после реакции?
3. Найти молекулярную формулу соединения бора с водородом, если масса 1л этого газа равна массе 1л азота, а содержание бора в веществе составляет 78,2%.
4. Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Вариант № 26
1. Определить молярную массу эквивалента металла, если 0,195г металла вытесняют 56мл водорода при нормальных условиях.
2. Смесь водорода и хлороводорода объёмом 7л (н.у.) пропустили через избыток раствора нитрата серебра, получив осадок массой 28,7г. Определите объёмную долю водорода в смеси.
3. Вычислить массу азота, содержащегося в 1кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3; в) аммофоса (NH4)2HPO4.
4. Написать уравнения реакций, доказывающих кислотный характер SeO2, SO3, Mn2O7, P2O5, CrO3.
Вариант № 27
1. Определить молярные массы эквивалентов окислителя и восстановителя в реакции, соответствующей уравнению:
KNO3 + KI + H2SO4 → NO + I2 + K2SO4 + H2O
2. Определить сколько воды в г получится при сгорании смеси 10г водорода и 10л кислорода.
3. Найдите простейшую формулу соединения, имеющего следующий состав (%): меди 25,48, серы 12,82, кислорода 25,64, воды 36,06.
4. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения:
Ba → BaO → BaCl2 → Ba(NO3)2 → BaSO4
Mg → MgSO4 → Mg(OH)2 → MgO → MgCl2
Вариант №28
1. Вычислить молярную массу эквивалента кислоты, если на нейтрализацию 0,18г её пошло 0,1г КОН.
2. На смесь меди и оксида меди (II) массой 75г подействовали избытком концентрированной азотной кислоты. При этом образовался газ объёмом 26, 88л (н.у.). Определить массовую долю оксида меди (II) в исходной смеси.
3. Найдите простейшую и молекулярные формулы производного газообразного углеводорода, если в нём содержится 37,2% углерода, 7,8% водорода и 54,9% хлора. Относительная плотность паров этого вещества по воздуху равна 2,22.
4. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Zn → K2ZnO2; S → H2SO3;
NH3 → НNO3; Cu → CuS.
Вариант №29
1. При взаимодействии 0,75г двухвалентного металла с водой выделилось 420мл водорода, измеренного при н. у. Определить атомную массу металла и назвать этот металл.
2. Смесь оксида кальция с оксидом кремния массой 420г обработали соляной кислотой. При этом образовалось соединение, масса которого оказалась равной 280г. Определить процентный состав смеси.
3. Какова простейшая и молекулярные формулы газообразного углеводорода, если в нём содержится 81,82% углерода и 18,18% водорода, а 10–3 м3 этого углеводорода при н.у. весят 2,6*10–3кг .
4. Какие соли можно получить, имея в своём распоряжении CuSO4, AgNO3, K3PO4, BaCl2 ?. Написать уравнения реакций и назвать полученные соли.
Вариант № 30
1. Окислением 1,4г металла получили 1,6г оксида. Вычислить эквивалентную массу металла.
2. 6г смеси алюминия и меди обработали соляной кислотой и собрали 3,7л водорода (н.у.). Определить процентный состав смеси.
3. Найдите молекулярную формулу вещества, если относительная плотность паров этого вещества по водороду равна 67,5, а состав вещества следующий (%): 23,7 серы, 23,7 кислорода, 52,6 хлора.
4. Как доказать амфотерный характер ZnO, Al2O3, Sn(OH)2, Cr(OH)3?
Тема №3 Растворы
Растворы – гомогенные (однородные) системы, состоящие из двух и более компонентов и продуктов их взаимодействия. В растворах вещества находятся в виде молекул, атомов и ионов.
Раствор, в котором данное вещество при данной температуре уже больше не растворяется, называется насыщенным, а раствор, в котором может раствориться добавочное количество данного вещества – ненасыщенным. При охлаждении насыщенных растворов растворимость большинства твёрдых веществ уменьшается, и они выделяются в виде кристаллов различной формы. Такой процесс называется кристаллизацией.
Растворимость, или коэффициент растворимости – это отношение массы вещества, образующего насыщенный раствор при данной температуре, к объёму растворителя. Растворимость измеряется в г/100 мл. Растворимость веществ весьма различна. Она зависит как от природы растворителя, так и от природы растворённого вещества. По растворимости в воде все вещества делятся на хорошо растворимые (сахар – в 100 мл растворяется 200 г), малорастворимые (гипс – в 100 мл растворяется 0,2 г) и практически нерастворимые (хлорид серебра – в 100 мл растворяется 1,5*10–4 г). Растворимость веществ зависит от температуры. Для большинства твёрдых веществ растворимость при повышении температуры увеличивается.
Растворы бывают концентрированные и разбавленные. Концентрированным называется раствор, содержащий такое количество растворённого вещества, которое сравнимо с количеством растворителя. Например, в 100 г воды растворено 30 г медного купороса. Это концентрированный раствор. Разбавленный раствор содержит очень малое количество растворённого вещества по сравнению с количеством растворителя. Например, в 100 г воды растворено 0,2 г медного купороса. Границы между концентрированным и разбавленным растворами условны.
Количественный состав раствора характеризуют концентрацией. Существуют различные способы точного выражения концентраций растворов: массовая доля растворённого вещества, молярность, моляльность и титр.
Массовая доля растворённого вещества показывает отношение массы растворённого вещества к общей массе раствора. Массовую долю выражают в долях единицы или в процентах: 0,3, или 30%, а воды – 70 г.
m вещ. m вещ.

 ω = mр-ра или ω = mр-ра * 100%. (1)
ω = mр-ра или ω = mр-ра * 100%. (1)
Существует зависимость между содержанием растворённого вещества и его плотностью. Плотность – ρ измеряется в г/см3 или кг/м3.
Масса раствора равна: m = Vр-ра * ρ, таким образом, массовая доля вещества в растворе:
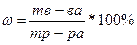 (2)
(2)
Молярность показывает число молей растворённого вещества, содержащегося в 1 л раствора (моль/л). Если в 1 л раствора содержится 1 моль вещества, то такой раствор называется молярным, 2 моля – двумолярным (2М), 0,1 моль – децимолярным (0,1М), 0,01 моль – сантимолярным (0,01М), 0,001 моля – миллимолярным (0,001М).
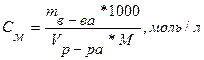 (3)
(3)
Моляльность показывает число молей растворённого вещества, содержащегося в 1000 г растворителя.
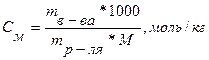 (4)
(4)
Титр раствора показывает число граммов растворённого вещества, содержащегося в 1 мл раствора: 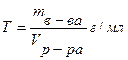 (5)
(5)
Нормальность показывает число молярных масс эквивалента растворённого вещества, содержащегося в 1 л раствора (моль-экв/л).
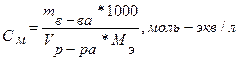
Между молярностью и массовой долей растворённого вещества в % существует зависимость: 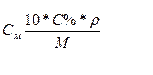
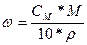
Масса раствора и масса растворённого вещества обратно пропорциональны друг другу:
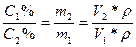
Пример. Вычислить молярность, моляльность, титр и массовую долю поваренной соли в растворе, полученном растворением 5 г соли в 295 г воды (ρ=1,01 г/мл).
1) 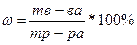
mр-ра = m в-ва + m H2O = 5 + 295 = 300 (г)
 ω = 300 * 100 = 1,66%
ω = 300 * 100 = 1,66%
2) m в-ва * 1000
 См = V * M
См = V * M
mр-ра 300

 Vр-ра = ρ = 1,01 = 297 мл
Vр-ра = ρ = 1,01 = 297 мл
М = 58 г/моль
 5 * 1000
5 * 1000
См = 297 * 58 = 0,21 моль/л
mв-ва * 1000 5 * 1000

 3) Сm = mр-ля * М = 295 * 58 = 0,21 моль/г
3) Сm = mр-ля * М = 295 * 58 = 0,21 моль/г
4) 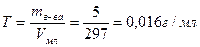
5) 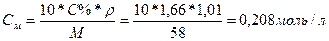
6) 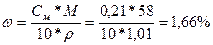
Наиболее доступным и широко распространённым способом измерения плотности растворов является измерение плотности с помощью ареометра. Действие ареометра основано на законе Архимеда: выталкивающая сила, действующая на погруженный прибор, зависит от плотности раствора. Чем больше плотность раствора, тем в большей степени ареометр выталкивается из раствора, поэтому отсчёт плотности по шкале ареометра производится сверху вниз.
Дата добавления: 2016-09-06; просмотров: 4768;











