Работа 2. Реакции катионов второй аналитической группы
Цель: изучить характерные качественные реакции наиболее распространенных катионов II аналитической группы, схему анализа катионов II группы.
Задачи:провести реакции обнаружения катионов серебра, свинца и ртути (I), отметить их особенности, оформить лабораторную работу, ответить на теоретические вопросы, сделать выводы.
Оборудование:штатив с пробирками, водяная баня или стакан с горячей водой, пипетки на 1 мл, спиртовка, держатели для пробирок, спички, стеклянная палочка, фильтровальная бумага, медная пластина или монета, наждачная бумага.
Реактивы:
| 1. | соли серебра, свинца (II) и ртути (I) | 2. | гидроокись калия (натрия) – КОН (NaOH) |
| 3. | гидроокись аммония – 2н NH4OH (конц.) | 4. | раствор формальдегида разбавленный |
| 5. | йодид калия – KI | 6. | соляная кислота – 2н HCl |
| 7. | азотная кислота – HNО3 | 8. | сульфид натрия – Na2S |
| 9. | хромат или дихромат калия (K2CrO4, K2Cr2O7) | 10. | ацетат аммония – CH3COONH4 |
| 11. | серная кислота или ее соли (сульфаты калия или натрия) – H2SO4 | 12. | раствор дитизона в хлороформе (дифенилтиокарбазол) |
| 13. | уксусная кислота – 2М CH3COOH | 14. | родизонат натрия – 0,2% раствор Na2C6O6 |
| 15. | тартратный буферный раствор, 1 мл раствора которого содержит 0,019 г гидротартрата натрия и 0,015 г винной кислоты | 16. | хлорид олова (II) – SnCl2, должен быть свежеприготовленным, т.к. SnCl2 может окисляться на воздухе до SnCl4 |
2.1. Реакции катиона серебра Ag+
ВНИМАНИЕ! Соли серебра ядовиты! Работать осторожно!
Опыт 2.1.1. Действие щелочей
При действии щёлочи на раствор соли серебра образуется гидроокись серебра, которая тут же распадается на Ag2O, выпадающую в виде бурого осадка, и воду:
AgNO3 + NaOH → AgOH↓ + NaNO3
2AgOH → H2O + Ag2O
2AgNO3 + 2NaOH →Ag2O↓ + H2O + 2NaNO3
Оксид серебра растворяется в растворе аммиака c образованием комплексного соединения:
Ag2O + 4NH4OH → 2[Ag(NH3)2]OH + 3H2O
Растворимость оксида серебра Ag2O в аммиаке используют для отделения иона Ag+ от иона [Hg2]2+. Для проведения отделения необходимо осадок хлорида серебра и ртути (I) обработать NH4OH на фильтре. При этом образующийся осадок Ag2O растворяется, а Hg2Cl2 взаимодействует с NH4OH с образованием чёрного осадка металлической ртути и амидосоединения, нерастворимого в избытке реактива.
Осадок не растворим в азотной кислоте.
Выполнение опыта:
В две пробирки внести по несколько капель раствора соли серебра. В одну пробирку добавить такой же объём щёлочи, а в другую – по каплям прилить 2н раствор NH4OH.
Затем в обеих пробирках испытать растворимость образовавшихся осадков в NH4OH, добавив избыток раствора гидроксида аммония к осадкам.
Записать наблюдаемые явления и уравнения происходящих реакций в молекулярном и молекулярно-ионном виде. Назвать образовавшееся комплексное соединение.
Опыт 2.1.2. Действие соляной кислоты (группового реагента)
При взаимодействии нитрата серебра и соляной кислоты образуется осадок хлорида серебра:
AgNO3 + HCl = AgCl↓+ HNO3
Осадок растворяется в избытке NH4OH и не растворим в азотной кислоте:
AgCl ↓+ 2NH3 = [Ag(NH3)2]Cl
При подкислении раствора этого комплекса снова выпадает осадок хлорида серебра:
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
Реакция с растворимыми хлоридами является фармакопейной.
Выполнение опыта:
В 2 пробирки поместить по 3-4 капли раствора AgNO3 и столько же 2н раствора HCl. Наблюдать выпадение рыхлого белого («творожистого») осадка AgCl.
Одну пробирку с осадком оставить и наблюдать разложение осадка на свету. Во второй пробирке проверить растворимость образовавшегося осадка в NH4OH. Для этого слить надосадочную жидкость и прибавлять гидроксид аммония NH4OH по каплям. Затем в пробирку с растворенным в аммиаке осадком AgCl, добавить несколько капель концентрированного раствора HNO3 до появления осадка.
Записать наблюдаемые явления и уравнения происходящих реакций в молекулярном и молекулярно-ионном виде.
Опыт 2.1.3. Действие формальдегида
При действии альдегидной группы ионы серебра восстанавливаются до металлического серебра. Реакция идет по уравнению:
AgNO3 + 2NH4OH = [Ag(NH3)2]NO3 + 2H2O
2[Ag(NH3)2]NO3 + H2O + HCOH = 2Ag↓ + HCOOH + 2NH4NO3 + 2NH3
Реакции мешают ионы ртути и сильные окислители.
Образующийся при реакции гидроксид серебра - вещество непрочное и легко распадается на оксид серебра и воду:
AgNO3 + NH4OH = AgOH + NH4NO3
2AgOH = Ag2O + H2O
Оксид серебра обладает свойством растворяться в аммиаке, как уже было рассмотрено выше:
Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + Н2O
Окислительное действие оксида серебра объясняется тем, что это вещество является оксидом благородного металла, поэтому оксид неустойчив и при наличии восстановителя, т.е. вещества, легко окисляющегося, он легко отдает кислород, вследствие чего происходит выделение (восстановление) металлического серебра:
HCOH + Ag2O = HCOOH + 2Ag
HC-OH + 2[Ag(NH3)2]OH = HCOOH + 2Ag + 4NH3 + H2O
Серебряное зеркало образуется в том случае, если восстанавливающееся серебро осаждается на гладких стенках сосуда из не слишком концентрированных растворов. Малейшие загрязнения мешают восстанавливающемуся серебру "уцепиться" за стекло и заставляют его выделяться в виде рыхлого осадка. Значительно меньшее влияние на успех опыта оказывает характер нагревания. Если сосуд недостаточно чист, то даже самое осторожное нагревание не дает зеркала, и наоборот, если сосуд подготовлен тщательно, то даже нагревание смеси на открытом огне может дать желаемый результат.
Выполнение опыта:
В чистую пробирку поместить 3-4 капли раствора нитрата серебра AgNO3, добавить раствор аммиака NH4OH до растворения осадка и 1-2 капли разбавленного раствора формальдегида (формалина). Смесь подогреть на водяной бане. Наблюдать образование металлического серебра на стенках пробирки (реакция «серебряного зеркала»).
Реакцию можно проводить и на листе фильтровальной бумаги, в этом случае появляется черное пятно.
Реакция является фармакопейной.
Опыт 2.1.4. Реакция с бромид- и йодид-ионами
Йодистоводородная кислота и ее соли образуют с ионами серебра желтоватый осадок йодида серебра, практически нерастворимый в растворе аммиака. При действии йодида калия KI на раствор соли серебра образуется жёлтый осадок AgI, который растворяется в избытке насыщенного раствора KI:
AgI + 2KI → K2[AgI3]
Если раствор разбавить водой, то AgI снова выпадает в осадок.
Осадок также растворим в растворе тиосульфата натрия с образованием комплексного иона:
Ag+ + I–→AgI↓
AgI + 2Na2S2O3 →Na3[Ag(S2O3)2] + NaI
Выполнение опыта:
К нескольким каплям раствора соли серебра прибавить по каплям раствор KI до растворения образующегося осадка, затем раствор разбавить водой и вновь наблюдать выпадение осадка.
Записать уравнения наблюдаемых процессов в тетрадь. Назвать образовавшееся комплексное соединение.
Тот же опыт провести с бромидом калия.
Записать наблюдения и уравнения реакций.
Опыт 2.1.5. Реакция с хроматом или дихроматом калия
Растворимые хроматы (дихроматы) образуют с катионами II группы, в том числе и с ионом серебра, в нейтральных или слабокислых средах малорастворимые окрашенные соединения:
2AgNO3 + К2CrO4 → Ag2CrO4↓ + 2КNO3
2Ag+ + CrO42–→Ag2CrO4↓ (кирпично-красный осадок)
Хромат серебра растворим в избытке аммиака.
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора нитрата серебра и добавить 3-4 капли дистиллированной воды и 1-2 капли хромата калия К2CrO4. Наблюдать образование осадка.
Изучить отношение осадка к раствору аммиака.
Записать наблюдения и уравнения протекающих реакций.
2.2. Реакции катиона свинца (II ) Pb2+
ВНИМАНИЕ! Соединения свинца токсичны! Работать осторожно!
Опыт 2.2.1. Действие соляной кислоты (группового реагента)
При взаимодействии нитрата свинца и соляной кислоты образуется осадок хлорида свинца:
Pb(NO3)2 + 2HCl = PbCl2↓+ 2HNO3
Осадок легко растворяется при нагревании на водяной бане, а при охлаждении выпадает вновь.
Выполнение опыта:
К небольшому количеству (1-2 мл) раствора соли свинца прилить столько же соляной кислоты, наблюдать образование белого осадка.
Разлить раствор с осадком в две пробирки. В одну из них добавить дистиллированной воды и встряхнуть, другую нагреть на водяной бане. Затем остудить пробирку. Что наблюдается? Сделать вывод о растворимости хлорида свинца. Составить молекулярное и молекулярно-ионные уравнения реакции образования хлорида свинца.
Опыт 2.2.2. Действие йодида калия
Йодид калия образует с ионами Pb2+ при рН = 3 желтый осадок йодида свинца:
Pb2+ + 2I–→ PbI2↓
KI нельзя брать в избытке во избежание растворения осадка PbI2 вследствие комплексообразования иона свинца с йодид-ионом. Образуются тетрайодоплюмбат (II)-ионы [PbI4]2-:
PbI2↓ + 2I- → [PbI4]2-
Осадок йодида свинца растворим в горячей воде, в растворе уксусной кислоты. После медленного охлаждения раствора из него снова выпадают красивые золотисто-желтые кристаллы йодида свинца (реакция «золотого дождя»).
Этой реакции мешает присутствие катионов Ag+, Hg22+ и Hg2+.
Реакция с йодид-ионами является фармакопейной.
Выполнение опыта:
К 1-2 мл раствора соли свинца добавить 1-2 мл йодида калия или натрия (KJ или NaJ). Наблюдать появление ярко-желтого осадка йодида свинца.
К полученному осадку прилить 1-2 мл воды и 1 мл уксусной кислоты, затем нагреть, можно на водяной бане, до полного растворения осадка. Дать остыть, или поместить слегка остывшую пробирку в стакан с холодной водой, до появления красивых кристалликов золотого цвета («алхимическое золото»).
Записать наблюдение, составить молекулярное и молекулярно-ионные уравнения реакции.
Опыт 2.2.3. Реакция с серной кислотой (сульфатами)
Катионы Pb2+ при взаимодействии в растворе с сульфат-ионами SO2- образуют белый осадок сульфата свинца PbSO4:
Pb2+ + SO42- ® PbSO4¯
Осадок растворяется при нагревании в щелочах (в отличие от осадков сульфатов кальция, стронция и бария):
PbSO4¯ + 4NaOH ® Na2 [Pb(OH)4] + Na2SO42-
PbSO4 ¯ + 4OH- ® [Pb(OH)4]- + SO42-
Растворяется также в концентрированной серной кислоте:
PbSO4¯ + H2SO4 (конц.) ® Pb(HSO4)2
PbSO4¯ + 2H+ ® Pb2+ + 2HSO4-
Растворяется в 30 % растворе ацетата аммония:
2PbSO4¯ + 2СH3COONH4 ® [Pb2(СH3COO)2]SO4 + (NH4)2SO4
Открытию катионов свинца в виде сульфата свинца мешают катионы, образующие малорастворимые сульфаты (Ca2+,Sr2+,Ba2+, Hg2+ и др.).
Выполнение опыта:
В пробирку внести 5 капель раствора Pb(NO3)2, прибавить столько же капель раствора серной кислоты (или сульфата натрия или калия). Наблюдать выпадение белого осадка сульфата свинца.
Осадок разделить на две части, поместив их в две разные пробирки. К одной части прибавить раствор щелочи, к другой - 30 % раствор ацетата аммония. Наблюдать растворение осадка в обоих случаях.
Записать наблюдение, молекулярное и молекулярно-ионные уравнения реакции.
Опыт 2.2.4. Реакция с хроматом калия K2CrO4
Хромат калия с катионами свинца Pb2+ образует осадок хромата свинца PbCrO4 желтого цвета, растворимый в сильных кислотах и щелочах, но нерастворимый в уксусной кислоте:
Pb2+ + CrO42- ® PbCrO4¯
2PbCrO4¯ + 2H+ ® 2Pb2+ + Cr2O72- + H2O
PbCrO4¯ + 3OH- ® [Pb(OH)3]- + CrO42-
Выполнение опыта:
В пробирку внести 2-3 капли раствора соли свинца, добавить к нему 2-3 капли раствора хромата калия. Полученный осадок разделить на две части. В первую пробирку с осадком добавить 4-5 капель 2М раствора NaOH или КОН. Во вторую пробирку с осадком добавить 4-5 капель 2М раствора уксусной кислоты СН3СООН.
Записать наблюдения и составить уравнения реакций в молекулярном и ионно-молекулярном виде.
Опыт 2.2.5. Реакция с дитизоном (дифенилтиокарбазолом)
Дитизоновый метод наиболее чувствителен и прост для определения содержания свинца в воде. При реакции дитизона с ионами свинца образуется дитизон свинца – внутрикомплексное соединение, раствор которого в органических растворителях окрашен в ярко-красный цвет.
Определению свинца мешают все катионы (Mn2+, Fe2+, Co2+, Ni2+, Cu+, Cu2+, Sn2+, Ag+ , Zn2+, Cd2+, Hg22+, Hg2+), образующие дитизонаты, но их можно отделить, создавая определенное значение рН раствора. В этом же интервале находится оптимальная кислотность для экстрагирования дитизоната цинка, поэтому цинк предварительно связывают добавлением гексацианоферрата (II) калия. Среда реакции нейтральная или слабощелочная.
2 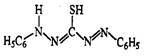 + Pb2+ = + Pb2+ =
| 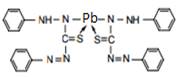
|
Выполнение опыта:
В пробирку внести 4-5 капель раствора соли свинца, добавить 2-3 капли раствора дитизона в хлороформе, взболтать и наблюдать окрашивание хлороформного слоя в красный цвет. Записать наблюдение и уравнение реакции в тетрадь.
Опыт 2.2.6. Реакция с сульфид-ионами
Катионы свинца при реакции с сульфид-ионами S2- образуют черный осадок сульфида свинца PbS:
Pb2+ + S2- ® PbS¯
Осадок растворяется в азотной кислоте.
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 2-3 капли раствора соли свинца (II) и прибавить 2-3 капли раствора сульфида натрия Na2S. Выпадает черный осадок сульфида свинца PbS.
Изучить отношение осадка к азотной кислоте, добавив последнюю в пробирку с осадком.
Записать наблюдение и уравнение реакции в молекулярном и молекулярно-ионном виде в тетрадь.
Опыт 2.2.7. Реакция с родизонатом натрия Na2C6O6
Катионы свинца образуют с органическим реагентом - родизонатом натрия окрашенный комплекс синего цвета, по-видимому, состава Pb3(C6O6)2(OH)2, который в слабокислой среде рН = 2,8 (тартратный буферный раствор, 1 мл раствора которого содержит 0,019 г гидротартрата натрия и 0,015 г винной кислоты) изменяет окраску на красную.
Реакция высокочувствительна. Позволяет открывать катионы свинца даже при очень низких концентрациях.
Реакцию обычно проводят капельным методом на фильтровальной бумаге. Мешают катионы Ag+,Cd2+,Sr2+,Ba2+,Tl+, Sn2+.
Выполнение опыта:
На лист фильтровальной бумаги нанести каплю раствора Pb(NO3)2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Образуется синее пятно или кольцо. На пятно нанести каплю тартратного буферного раствора. Цвет пятна изменяется на красный.
Записать наблюдения в тетрадь.
2.3. Реакции катиона ртути (I) Hg2 2+
ВНИМАНИЕ! Соединения ртути очень токсичны! Работать осторожно!
Опыт 2.3.1. Действие соляной кислоты (группового реагента)
Соляная кислота и растворимые в воде хлориды с катионом ртути (I) образуют белый осадок хлорида ртути (I) - Hg2Cl2 (каломель):
Hg22+ + 2Cl- ® Hg2Cl2¯
Осадок хлорида ртути (I)Hg2Cl2 растворяется только в концентрированной азотной кислоте и "царской водке", окисляясь при этом в нитрат ртути (II) Hg(NO3)2 или в хлорид ртути (II) HgCl2.
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора соли ртути (I) Hg2(NO3)2 и добавить к нему 3-4 капли 2М раствора HCl. Оставить пробирку с осадком для выполнения следующего опыта.
Записать наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде.
Опыт 2.3.2. Реакция хлорида ртути (I) с аммиаком
Наиболее характерной, достаточно чувствительной и специфической реакцией на катионы одновалентной ртути является взаимодействие хлорида ртути (I) с раствором аммиака. Этой реакцией, как правило, и пользуются в аналитических лабораториях для открытия катионов одновалентной ртути Hg22+.
C раствором аммиака хлорид ртути (I) взаимодействует с образованием хлорида димеркураммония, который вследствие чрезвычайной неустойчивости немедленно разлагается на трудно растворимый белый осадок меркураммоний или амидохлорид ртути (II) и металлическую ртуть, последняя при этом выделяется в мелко раздробленном (тонкодисперсном) состоянии, придавая осадку черную окраску:
Hg2Cl2 + 2NH4OH = [Hg2NH2]Cl + NH4C1 + 2Н2O
[NH2Hg2]Cl = [HgNH2]Cl + Hg0
Суммарное уравнение:
Hg2Cl2¯ + 2NH3 ® [Hg2NH2]Cl¯ + Hg0¯ + NH4Cl
Следовательно, если обработать осадок, полученный в предыдущем опыте Hg2Cl2 (белого цвета) раствором аммиака, то, вследствие указанной реакции, белый осадок приобретает черную окраску.
Выполнение опыта:
К образовавшемуся в предыдущем опыте осадку добавить 5-10 капель концентрированного раствора аммиака. Наблюдать появление черного осадка металлической ртути. Записать наблюдения и уравнения реакций в тетрадь.
Опыт 2.3.3. Действие щелочей
Щелочи (NaOH, KOH) выделяют из растворов, содержащих катионы Hg22+, черный осадок оксида ртути (I) Hg2O:
Hg2(NO3)2 + 2KOH = 2HgOH¯ + 2KNO3
2HgOH → Hg2O¯ + Н2O
Hg22+ + 2ОН- ® Hg2O¯ + Н2O
Осадок растворяется в азотной и концентрированной уксусной кислотах.
Выполнение опыта:
В пробирку внести 3-4 капли раствора Hg2(NO3)2 и прибавить 2-3 капли раствора NaOH или KOH. Выделяется черный осадок оксида ртути (I). Изучить отношение осадка к азотной и концентрированной уксусной кислотам.
Записать наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде.
Опыт 2.3.4. Восстановление ртути (I) металлической медью
Металлическая медь восстанавливает Hg22+ до металла с образованием амальгамы:
Hg22+ + 2Cu0 ® 2Hg + Cu2+
Cu0 + Hg2(NO3)2 = 2Нg0 + Сu(NО3)2
При очень малых концентрациях Hg22+ пятно получается светло-серого цвета, так как на поверхности медной пластинки образуется амальгама меди. Если полученное при этом пятно протереть тканью или бумагой, то оно обретает вид зеркала.
Открытию ртути этой реакцией мешают только катионы двухвалентной ртути, дающие аналогичный эффект, и в значительных концентрациях ионы серебра, которые медью также восстанавливаются, образуя под каплей серое пятно металлического серебра. В отсутствии же Hg2+ и больших концентрациях Ag+ эта реакция является специфической на катионы одновалентной ртути.
Выполнение опыта:
На очищенную наждачной бумагой медную монету или медную пластинку поместить 2-3 капли раствора соли ртути (I). Через 2-3 минуты на пластинке появится серое пятно металлической ртути. Затем необходимо смыть раствор водой и протереть поверхность кусочком фильтровальной бумаги. При этом пятно обретает вид зеркала.
Записать наблюдения и уравнение реакции в тетрадь. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
Опыт 2.3.5. Восстановление ртути (I) хлоридом олова (II)
Ион одновалентной ртути может быть восстановлен до металлической ртути с помощью хлорида олова (II). При этом вначале образуется белый осадок хлорида одновалентной ртути, который при стоянии темнеет вследствие восстановления ионов ртути Hg22+ до металлической ртути Hg0:
Hg2(NO3)2 + SnCl2 = Hg2Cl2¯ + Sn(NO3)2
Hg22+ + 2Cl- ® Hg2Cl2¯
Hg2Cl2¯ + Sn2+ ® 2Hg0¯ + Sn4+ + 2Cl-
Хлорид двухвалентного олова SnCl2 должен быть свежеприготовленным, т.к. SnCl2 может окисляться на воздухе до четырехвалентного олова SnCl4.
Выполнение опыта:
К капле раствора соли одновалентной ртути добавить 2-3 капли раствора хлорида олова (II). Наблюдать образование белого осадка. Оставить осадок на некоторое время – осадок темнеет. Записать наблюдение и уравнения окислительно-восстановительной реакции, рассмотреть с помощью метода электронного баланса.
Дата добавления: 2020-11-18; просмотров: 2509;











