Общая характеристика катионов третьей группы
Металлы данной аналитической группы расположены во II группе периодической системы Д.И. Менделеева, называются щелочно-земельными и характеризуются высокой химической активностью, растущей от кальция к барию.
Большинство солей щелочноземельных металлов малорастворимы в воде. Однако, хлориды, бромиды, иодиды, гидрокарбонаты, нитраты, сульфиды катионов III группы хорошо растворимы, тогда как сульфаты, фосфаты, карбонаты, оксалаты, хроматы мало растворимы в воде (см. приложение таблицу «Растворимости солей и оснований в воде»).
В водных растворах катионы III группы бесцветны и окраска их солей или комплексов обусловлена окраской аниона. Например, желтая окраска хроматов катионов III группы определяется анионом СrO42–.
Действие группового реагента. Групповым реагентом на катионы III группы является раствор разбавленной серной кислоты (1 моль/л) в присутствии этанола (1 : 1 по объему).
При действии группового реагента катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронция SrSO4 и бария BaSO4. Например:
BaCl2 + H2SO4 →BaSO4↓ + 2 HCl
SrCl2 + Na2SO4 →SrSO4↓ + 2 NaCl
Свинец осаждается в виде сульфата свинца PbSO4 , поэтому иногда катион двухвалентного свинца относят к третьей аналитической группе катионов. Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10-5, Ks° (SrSO4) = 3,2 10-7, Ks°(BaSO4) = 1,110-10, Ks°(PbSO4) = 1,6 10-8.
При действии группового реагента катионы кальция не полностью осаждаются из водного раствора в форме осадка сульфата кальция – часть ионов Ca2+ остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается. При соотношении этанол : вода примерно 1 : 1 удается практически полностью осадить ионы кальция в виде малорастворимого сульфата. Растворимость СaSO4 в смешанном растворителе снижается за счет понижения энергии сольватации ионов по сравнению с таковой в водном растворе.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 . Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария - не растворяются.
Реакция с фосфатами. Растворимые фосфаты (например, Na2HPO4) образуют с катионами III группы малорастворимые бесцветные соединения различного состава. При рН = 5–6 образуются бесцветные аморфные осадки гидрофосфатов МeНРО4, тогда как в нейтральной и щелочной средах образуются средние фосфаты. Фосфаты катионов III группы растворяются как в сильных кислотах, так и в уксусной кислоте:
Сa3(PO4)2 + 6 НCl →3 CaCl2 + 2 H3PO4
Сa3(PO4)2 + 4 CH3COOH →Ca(H2PO4)2 + 2 Ca(CH3COO)2
Реакция с оксалатами. Растворимые оксалаты образуют с катионами III группы малорастворимые кристаллические бесцветные осадки, заметно различающиеся по растворимости в зависимости от катиона. Наименее растворимым является осадок оксалата кальция. Все оксалаты катионов III группы хорошо растворимы в соляной и азотной кислотах, а оксалаты бария и стронция растворяются при нагревании в растворе уксусной кислоты.
Ba2+ + C2O4 2–→ BaC2O4↓
BaC2O4 + 2HCl → BaCl2 + H2C2O4
Реакция с сильными основаниями. Растворы сильных оснований КОН и NaОН образуют с концентрированными растворами катионов III группы бесцветные аморфные осадки гидроксидов. Наряду с гидроксидами могут осаждаться и карбонаты катионов III группы, поскольку растворы щелочей на воздухе поглощают углекислый газ. При действии растворов сильных оснований и аммиака, не содержащих углекислого газа, на разбавленные растворы катионов III группы осадков гидроксидов не образуется:
Ca2+ + 2OH– → Ca(OH)2
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Реакция с хроматами (дихроматами). Растворимые хроматы (дихроматы; последние существуют в водном растворе в равновесии с хроматами) образуют с катионами бария и стронция в нейтральном и слабощелочном растворе желтые кристаллические осадки хроматов:
Cr2O7 2– + H2O→ 2 HCrO4
HCrO4–→ CrO42– + H+
Ba2+ + CrO42–→ BaCrO4↓
Растворимость хромата кальция достаточно велика и ионы кальция практически не осаждаются из водных растворов в виде СaCrO4. В слабокислых растворах при рН = 4–5 (например, в ацетатном буферном растворе) образуется только самый малорастворимый осадок BaCrO4. Последний растворим в растворах сильных кислот (например, HCl или HNO3).
Реакция с карбонатами. Ионы Ba2+, Ca2+, Sr2 + (в отличие от катионов I-ой группы) образуют малорастворимые в воде карбонаты. Поэтому их можно осаждать действием карбоната аммония (NH4)2CO3.
| BaCl2 + (NH4)2CO3 | = | BaCO3¯ + 2NH4Cl |
| Ba2+ + CO32- | = | BaCO3¯ |
| CaCl2 + (NH4)2CO3 | = | CaCO3¯ + 2NH4Cl |
| Ca2+ + CO32- | = | CaCO3 ¯ |
Карбонат аммония (NH4)2CO3 подвергается гидролизу:
| (NH4)2CO3 + H2O | D | NH4HCO3 + NH4OH или |
| NH4+ + CO32- + H2O | D | HCO3- + NH4OH |
В результате гидролиза образуются кислые соли Ca(HCO3)2, Вa(HCO3)2 и Sr(HCO3)2 растворимы в воде, а это ведет к неполному осаждению катионов данной группы. Для подавления гидролиза карбоната аммония к раствору прибавляют гидроксид аммония (продукт гидролиза). В результате равновесие смещается влево и ион HCO 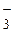 превращается в ион-осадитель
превращается в ион-осадитель 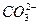 .
.
Помимо этого, карбонат аммония частично разлагается с образованием карбамината аммония, не осаждающего катионы II группы:
(NH4)2CO3 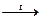 NH2COONH4 + H2O
NH2COONH4 + H2O
При нагревании раствора до 50-700С равновесие этой реакции смещается влево. Нагревание также способствует превращению аморфного осадка карбонатов в кристаллический, легче отделяемый при фильтровании и центрифугировании.
Таким образом, катионы 3-ей группы можно осаждать карбонатом аммония (NH4)2CO3 в присутствии NH4OH, NH4Cl и при нагревании раствора до 60-700С.
Таблица 3.1
Дата добавления: 2020-11-18; просмотров: 1170;











