Работа 3. Реакции катионов третьей аналитической группы
Цель: изучить характерные качественные реакции наиболее распространенных катионов III группы, схему анализа катионов III группы.
Задачи:провести реакции обнаружения катионов бария, кальция, стронция, отметить их особенности, оформить лабораторную работу, ответить на теоретические вопросы, сделать выводы.
Оборудование:штатив с пробирками, водяная баня, плитка, пипетки на 1 мл, спиртовка, держатели для пробирок, спички, предметные стекла, микроскоп, платиновая, нихромовая или алюминиевая проволока, стеклянная палочка, фильтровальная бумага.
Реактивы:
| 1. | соли бария, кальция и стронция | 2. | серная кислота – 1М H2SO4 |
| 3. | уксусная кислота – 2М и 0,05н CH3COOH | 4. | хромат и дихромат калия – K2CrO4, K2Cr2O7 |
| 5. | серная кислота | 6. | хлорид аммония – 4М NH4Cl |
| 7. | ацетат натрия – CH3COONа | 8. | соляная кислота – 2н HCl |
| 9. | карбонат аммония (NН4)2СO3 | 10. | оксалат аммония – (NН4)2С2O4 |
| 11. | этиловый спирт – C2H5OH | 12. | гидроксид натрия – NaOH |
| 13. | раствор аммиака – 2н NH4OH (конц.) | 14. | родизонат натрия – 0,2% раствор Na2C6O6 |
| 15. | гексацианоферрат (II) калия - свежеприготовленный насыщенный раствор К4[Fe(CN)6] | 16. | сульфат кальция – насыщенный раствор СаSO4 |
| 17. | азотная кислота – HNО3 | 18. | нитрит калия – сухая соль КNО2 |
| 19. | нитрат меди (II) – 2% раствор Cu(NО3)2 | 20. | карбонат натрия – насыщенный раствор Nа2СO3 |
| 21. | сульфат аммония – насыщенный раствор (NH4)2SO4 | 22. |
3.1. Реакции катиона бария Ba2+
ВНИМАНИЕ! Соединения бария токсичны! Работать осторожно!
Опыт 3.1.1. Реакция с серной кислотой (действие группового реагента)
Серная кислота и растворимые сульфаты с ионами бария Ва2+ образуют белый кристаллический осадок, нерастворимый в минеральных кислотах и щелочах:
BaCl2 + H2SO4 → BaSO4↓ + 2 HCl
Ba2+ + SO42- ® BaSO4¯
За исключением - концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2:
BaSO4¯ + H2SO4 → Ba(НSO4)2
При нагревании с растворами карбонатов (например, соды Na2CO3) сульфат бария превращается в малорастворимый в воде карбонат бария BaCO3, который растворяется в кислотах.
Предел обнаружения катионов бария данной реакцией составляет 10 мкг. Мешают катионы Ca2+, Sr2+, Pb2+.
Выполнение опыта:
Поместить в пробирку 1-2 капли раствора соли бария и добавить к нему 2-3 капли 1 М раствора серной кислоты H2SO4.
Записать наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
Опыт 3.1.2. Реакция с бихроматом калия K2Cr2O7
Бихромат калия осаждает из растворов солей бария желтый кристаллический осадок хромата бария BaCrO4, а не дихромат бария BaCr2O7, как можно было бы предположить. Объясняется это гидролизом дихромата калия, в результате которого в растворе присутствуют не только ионы Cr2O72-, но и ионы CrO42-:
Cr2O72- + H2OD2CrO42- + 2H+
Таким образом, уравнение имеет следующий вид:
2BaCl2 + K2Cr2O7 + H2O D 2BaCrO4 + 2KCl + 2HCl
Однако, осаждение Ва2+ при этом не может быть полным: образующаяся одновременно кислота (HCl) растворяет хромат бария и реакция идет в обратном направлении.
Для полного осаждения бария, например, для отделения Ва2+ от ионов Ca2+ и Sr2+, не дающих осадков с бихроматом калия, к раствору прибавляют еще и ацетат натрия. Благодаря чему сильная кислота заменяется слабой, в которой хромат бария не растворим:
HCl + CH3COONa = CH3COOH + NaCl
Практически берут некоторый избыток ацетата натрия, чтобы с уксусной кислотой он образовал ацетатную буферную смесь, поддерживающую рН ≈ 4-5, при котором происходит полное осаждение хромата бария.
Выполнение опыта:
К 1-2 мл соли бария прилить 1-2 мл бихромата калия. Добавить избыток раствора ацетата натрия. Что наблюдается? Испытать растворимость образовавшегося осадка в растворах кислот сильной (HCl) и слабой (СН3СООН). Записать молекулярное и молекулярно-ионное уравнения реакции образования осадка и растворения осадка в сильной кислоте.
Опыт 3.1.3. Реакция с оксалатом аммония (NH4)2C2O4.
Катионы Ba2+ образуют осадок при реакции с растворимыми оксалатами - белый BaC2O4:
Ba2+ + C2O4 2–→BaC2O4↓
BaC2O4 + 2 HCl →BaCl2 + H2C2O4
Осадок растворяется в соляной и азотной кислотах (HCl, HNO3), а при нагревании - и в CH3COOH.
Выполнение опыта:
К 1-2 мл соли бария прилить столько же раствора (NH4)2C2O4. Что наблюдается? Изучить отношение осадка к соляной и уксусной кислотам, в последнем случае пробирку нагреть.
Записать молекулярное и молекулярно-ионное уравнения реакции образования осадка.
Опыт 3.1.4. Реакция с карбонатами
Растворимые карбонаты, например, K2CO3, Na2CO3 или (NH4)2CO3 образуют с катионами III группы, в том числе и с ионами бария, малорастворимые бесцветные карбонаты. Выделившиеся карбонаты хорошо растворимы в уксусной, соляной и азотной кислотах. Карбонат аммония с ионами бария образует аморфный белый осадок ВаСО3, который при нагревании превращается в кристаллический:
ВаСl2 + (NH4)2CO3 = ВаСО3 + 2NH4Сl
Ba2+ + CO32– → BaCO3↓
BaCO3 + 2 Н+→ Ba2+ + СО2↑ + Н2О
Карбонаты катионов III группы растворяются в воде при насыщении ее углекислым газом с образованием кислых солей:
BaCO3 + СО2 + Н2О →Ba(НCO3)2
Выполнение опыта:
В пробирку поместить 3-5 капель соли бария, добавить 3-5 капель 2н раствора карбоната аммония (NH4)2CO3. После выпадения осадка содержимое пробирки нагреть. Аморфный осадок превращается в кристаллический.
Затем слить жидкость с осадка, разделить осадок на две части. Одну часть испытать на действие 2н раствором соляной кислоты НСl, а другую – 2н раствором уксусной кислоты СН3СООН.
Написать наблюдения и уравнения реакций растворения осадка в кислотах в молекулярной и ионной форме.
Опыт 3.1.5. Реакция с родизонатом натрия
Катионы Ba2+ реагируют с родизонатом натрия Na2C6O6 в нейтральной среде с образованием красно-бурого осадка родизоната бария:
Ba2+ + Na2C6O6 → BaC6O6↓ + 2Na+
При прибавлении раствора хлороводородной кислоты красно-бурый осадок родизоната бария превращается в ярко-красный гидроро-дизонат бария Ba(HC6O6)2.
Мешают катионы Pb2+.
Выполнение опыта:
Реакцию проводят капельным методом на фильтровальной бумаге. На лист фильтровальной бумаги наносят каплю раствора соли бария и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора НСl. Окраска пятна переходит из бурой в ярко-красную.
Опыт 3.1.6. Окрашивание пламени
Летучие соли бария окрашивают пламя в желто-зеленый цвет.
Выполнение опыта:
Чистую нихромовую проволоку опустить в насыщенный раствор соли бария или в сухую соль и затем внести её в пламя спиртовки.
Записать наблюдения в тетрадь.
3.2. Реакции катиона кальция Ca2+
Опыт 3.2.1. Реакция с серной кислотой
Серная кислота и растворимые сульфаты в концентрированных растворах образуют с катионом кальция Са2+ кристаллы гипса CaSO4×2Н2О белого цвета, имеющие игольчатую форму:
Сa2+ + SO42- + 2Н2О ® ¯ СaSO4 × 2Н2О
Выполнение опыта:
Поместить на предметное стекло 1 каплю раствора соли кальция, прибавить к нему 1 каплю 1М раствора H2SO4 и 1 каплю С2Н5ОН для уменьшения растворимости. Осторожно нагреть предметное стекло на водяной бане или над плитой до появления белых кристаллов гипса. Рассмотреть их под микроскопом.
Записать наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде. Зарисовать кристаллы в тетрадь.
Опыт 3.2.2. Реакция с оксалатом аммония (NH4)2C2O4.
Оксалат аммония с ионами кальция Са2+ образует белый кристаллический осадок CаC2O4, нерастворимый в уксусной кислоте, но растворимый в сильных кислотах:
Сa2+ + C2O42- ® CаC2O4¯
Так как катионы Ва2+, Sr2+ и Mg2+ с (NH4)2C2O4 тоже образуют белые мелкокристаллические осадки, то они мешают обнаружению катиона Ca2+.
Реакцию проводят в слабокислой среде (рН « 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак. Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
CаC2O4¯ + HCl ® CаCl2 + Н2C2O4
Реакция с оксалатом аммония фармакопейная.
Выполнение опыта:
К 1-2 мл соли кальция прилить 1-2 мл раствора (NH4)2C2O4, добавить столько же 2М раствора аммиака. Изучить растворимость образовавшегося мелкокристаллического осадка в растворах HCl и CH3COOH.
Реакцию можно провести другим способом. В пробирку внести 3 капли раствора CaCl2, прибавить каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Записать молекулярное и молекулярно-ионное уравнения реакции образования осадка.
Опыт 3.2.3. Реакция с карбонатом аммония (NH4)2CO3
Катионы кальция реагируют с карбонатом аммония так же как и катионы бария. Карбонат аммония с ионами кальция образует аморфный белый осадок СаСО3, который при нагревании превращается в кристаллический:
СаСl2 + (NH4)2CO3 ® СаСО3 + 2NH4Сl
Са2+ + CO32 - ® СаСО3
Выполнение опыта:
В пробирку поместить 3-5 капель соли кальция, добавить 3-5 капель 2н раствора карбоната аммония (NH4)2CO3 . После выпадения осадка содержимое пробирки нагреть. Аморфный осадок превращается в кристаллический.
Слить жидкость с образовавшегося осадка, разделить его на две части. Одну часть испытать на действие 2н раствором соляной кислоты НСl, а другую – 2н раствором уксусной кислоты СН3СООН.
Записать уравнения реакций растворения осадка в кислотах в молекулярной и ионной форме.
Опыт 3.2.4. Реакция с гексацианоферратом(II) калия
Катионы Ca2+ образуют с гексацианоферратом (II) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата (II) аммония и кальция (NH4)2Ca[Fe(CN)6]:
2NH4 + Ca2+ + [Fe(CN)6]4- ® (NH4)2Ca[Fe(CN)6]↓
Осадок нерастворим в уксусной кислоте. Мешают катионы Ba2+ и другие катионы, образующие осадки ферроцианидов.
Выполнение опыта:
В пробирку внести 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагреть раствор до кипения и прибавить 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Записать уравнения реакций в молекулярной и ионной форме.
Опыт 3.2.5. Реакция с родизонатом натрия
Катионы Ca2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 в щелочной среде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2:
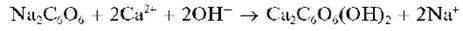
Реакция довольно чувствительна. Катионы Sr2+ и Ba2+ не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Выполнение опыта:
В пробирку внести 3-4 капли раствора CaCl2,столько же капель раствора NaOH и 2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги нанести каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6. Образуется пятно (или осадок) фиолетового цвета.
Записать наблюдения и уравнения реакций в молекулярной и ионной форме.
Опыт 3.2.6. Окрашивание пламени солями кальция (фармакопейный тест)
Летучие соли кальция окрашивают пламя газовой горелки (спиртовки) в оранжево-красный цвет.
Выполнение опыта:
Чистую нихромовую проволоку опустить в насыщенный раствор хлорида кальция или в сухую соль и затем внести её в пламя газовой горелки. Записать наблюдения в тетрадь.
3.3. Реакции катиона стронция Sr2+
Катион Sr2+не имеет специфических реакций.
Дата добавления: 2020-11-18; просмотров: 1714;











