Методы изучения активных центров ферментов
Представление об активном центре сформировалось в результате анализа данных по ингибированию реакций и химической модификации белковой молекулы. Необратимые ингибиторы блокируют каталитическую активность фермента, осуществляя химическую модификацию одной из групп, участвующих в каталитическом превращении субстрата. Обратимые ингибиторы, образуя комплекс с функциональной группой белка, вызывают либо существенное изменение свойств данной группы (неконкурентные ингибиторы), либо конкурентно блокируют сорбцию (комплексообразование) субстрата в области каталитического центра.
Рассмотрим некоторые примеры.
Сериновые протеазы и эстеразы. Каталитически активной группой многих ферментов является гидроксильная группа серина. В активном центре эта спиртовая группа играет роль нуклеофильного реагента в реакциях нуклеофильного замещения при гидролизе сложных эфиров, амидов, пептидов. Представителем семейства сериновых протеаз является простагландин-Н-синтаза, участвующая в метаболизме арахидоновой кислоты.
Простагландин-Н-синтаза. Аспирин (ацетилсалициловая кислота) представляет собой нестероидный противовоспалительный лекарственный препарат. Физиологическое действие препарата связано с его способностью ацетилировать Ser-514, входящий в центр сорбции арахидоновой кислоты - субстрата ПНС.
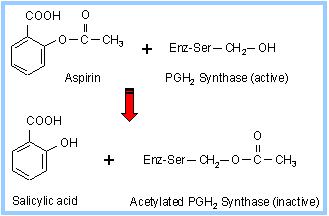
Рис. 1.5.2. Блокирование гидроксильной группы серина в активном центре простагландин-Н-синтазы
Аспирин выступает необратимым ингибитором лимитирующего фермента синтеза простагландинов. Последующий гидролиз модифицированного белка и анализ продуктов гидролиза позволили идентифицировать центр модификации фермента.
Несмотря на то, что метод химической модификации позволяет получить весьма важную информацию о природе активных центров ферментов, он имеет и определенные недостатки.
Функциональные группы белка, составляющие активный центр, могут быть замаскированы полипептидной цепью или остатками других аминокислот, что делает группы активного центра недоступными для реагента-модификатора. Химическая модификация, как правило, не является избирательной, химической реакции подвергаются сразу несколько аминокислотных остатков в белке. Это ведет к существенному изменению структуры белка, развитию инактивационных и денатурационных процессов, что может привести к потере ферментом каталитической активности даже в том случае, если химически модифицировались остатки, не входящие в каталитический центр. Выводы об участии тех или иных функциональных групп аминокислот в каталитическом процессе на основе данных по химической модификации белка могут быть сделаны с известной осторожностью и оговорками.
Таким образом, метод химической модификации не позволяет получить исчерпывающую информацию об участниках каталитического акта.
Как правило, для такого рода выводов требуются независимые структурные исследования.
Ситуация становится более однозначной, если химический модификатор встраивается в структуру специфического субстрата или ингибитора фермента. В этом случае модификатор адресно направляется в активный центр, что существенно увеличивает вероятность химической реакции с функциональной группой активного центра.
Новые возможности идентификации групп, входящих в активные центры ферментов, появились с развитием техники сайт-специфического мутагенеза. Для ферментов, экспрессию генов которых можно организовать с помощью генно-инженерных конструкций типа плазмид, оказалась возможной замена отдельных аминокислот на уровне ДНК с последующей экспрессией и изучением каталитических свойств получаемых белков. Это позволяет получить важную информацию об участии той или иной аминокислоты данного фрагмента полипептидной цепи в каталитическом акте. Однако и в этом случае при интерпретации результатов необходима известная осторожность, поскольку в белках имеется большое число аминокислот, формирующих структуру активного центра, но не принимающих непосредственное участие в акте катализа.
Окончательная информация о структуре активного центра активного центра может быть получена методом рентгеноструктурного анализа (РСА) и спектроскопии ядерного магнитного резонанса (ЯМР) высокого разрешения. В первом случае исследование проводят на кристаллах фермента, во втором ‒ исследуют растворы фермента. Для идентификации групп, принимающих участие в катализе, обычно используют образование комплекса ферментов с ингибиторами или мало реакционноспособными аналогами субстратов (т.н. квазисубстратами).
Метод РСА впервые был использован Липскомбом с сотрудниками при анализе активного центра карбоксипептидазы А. На рис. 1.5.3. показана структура карбоангидразы по данным рентгеноструктурного анализа.
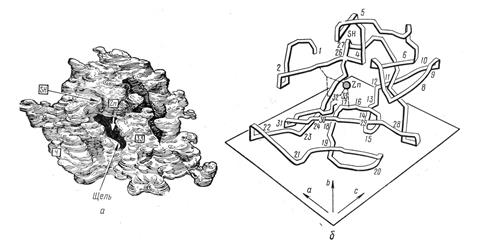
Рис. 1.5.3. Третичная структура карбоангидразы по данным рентгеноструктурного анализа: а) общий вид ферментной глобулы; б) пространственное расположение аминокислотных остатков
Структуру и свойства каждого белка определяет последовательность аминокислот. В настоящее время становится очевидным, что при большой вариабельности белков некоторые элементы структуры являются консервативными, и эти элементы в значительной степени определяют функцию белковой молекулы. Это особенно характерно для белков, выполняющих каталитическую функцию. Например, для гидролаз, составляющих около трети всех известных ферментов (приблизительно 1100 из 3700), типов структур каталитических центров всего четыре.
Чтобы ответить на вопросы, какие химические структуры образуют каталитический центр, каким образом аминокислоты, расположенные на разных, зачастую удаленных друг от друга участках полипептидной цепи, находят друг друга и формируют уникальную структуру, ‒ используют методы биоинформатики.
По мнению энзимологов в рамках одного суперсемейства ферментов сорбционный сайт, отвечающий за специфичность, может быть представлен многими вариантами аминокислотных остатков, соответствующими вариантам структуры субстратов. В то же время каталитические сайты, число типов которых весьма ограничено, являются консервативными (незаменимыми) элементами структуры. Для подтверждения этого положения был использован биоинформационный подход, основанный на сравнении последовательностей аминокислот в белках, объединенных в одно крупное семейство.
Был проведен анализ нескольких больших семейств ферментов, представленных в базе данных HSSP (www.sander.embl-heidelberg.de/). Выбор семейств ферментов был сделан на основании следующих критериев:
1) число анализируемых представителей семейства должно быть более 100; это необходимо для обеспечения статистической достоверности результатов;
2) для анализа следует выбирать семейства ферментов различных классов (оксидоредуктазы, гидролазы, изомеразы и т.д.);
3) по возможности следует выбирать ферменты, для которых установлена структура активных центров и с высокой степенью достоверности изучен механизм катализа.
Проведенный анализ показал, что в полипептидной цепи большая часть позиций аминокислот высоко вариабельна, это означает, что функционирование фермента не зависит от того, какую позицию занимает та или иная аминокислота. В то же время имеются позиции аминокислот, которых относительно немного. Эти позиции и соответствующие им аминокислоты называют консервативными. Именно они играют особую роль в функционировании фермента. Что же это за аминокислоты, и какова их роль?
Биоинформационный анализ ферментов всех классов показал, что наиболее часто консервативной аминокислотой является глицин. По рейтингу консервативности аминокислоты располагаются в следующем ряду: глицин > аспарагиновая кислота > цистеин > пролин > гистидин > аргинин > глутаминовая кислота. Это наиболее важные аминокислоты в ферментативном катализе. В сумме глицин и аспарагиновая кислота составляют примерно 50% всех консервативных аминокислот. Из наиболее часто встречающихся консервативных элементов структуры ферментов можно отметить глицин, аспарагиновую кислоту, цистеин, пролин и гистидин. Эти аминокислоты составляют примерно 70% всех консервативных элементов. Метионин и изолейцин практически никогда не бывают консервативными.
В свою очередь наиболее консервативные аминокислоты можно разделить на две принципиально разные группы:
1) аминокислоты, участвующие в активации молекул субстрата в качестве кислот и оснований (аспарагиновая кислота и гистидин);
2) аминокислоты, формирующие геометрию активного центра (глицин, цистеин, пролин).
Таким образом, статистический анализ показал, что каталитическую функцию фермента и архитектуру активного центра формирует небольшая, но определенная часть аминокислот, занимающих строго фиксированные позиции в полипептидной цепи. Консервативные аминокислоты являются либо кислотами или основаниями (электрофильные и нуклеофильные агенты), формирующими каталитический сайт, либо важными структурообразующими аминокислотами, формирующими структуру белка в целом.
Каталитическую функцию выполняют аспарагиновая кислота, гистидин, аргинин, и глутаминовая кислота. Структурообразующими аминокислотами являются глицин, цистеин, и пролин. Глицин и пролин, обеспечивающие возможность поворота цепи, необходимы для того, чтобы активный центр был образован аминокислотами, расположенными на разных участках полипептидной цепи. А цистеин необходим для фиксации необходимой конформации полипептидной цепи.
Природа сформировала активные центры ферментов из ограниченного числа компонентов. Большая часть активных центров ферментов всех классов сформирована из аспарагиновой и глутаминовой кислот, из гистидина и аргинина, из ионов нескольких металлов. Как следствие, число типов каталитических центров невелико. Например, для гидролаз, составляющих около трети всех известных ферментов, можно идентифицировать всего четыре основных типа структуры. Эффективные комбинации каталитических групп, характерные для одних реакций, природа активно использует для организации каталитических центров других типов реакций.
Полипептидная цепь обеспечивает организацию каталитических групп в активные центры. Как известно, в растворе практически исключены трехмолекулярные реакции и реакции более высоких порядков. В ферментативных процессах в реакции участвуют четыре (или пять) остатков различных аминокислот, организованных в полипептидную цепь. Ферментативный катализ не использует сильных химических агентов; компоненты, составляющие активные центры, ‒ это относительно слабые кислоты и основания. Однако они хорошо организованы в пространстве и, как следствие, весьма эффективны.
Дата добавления: 2020-10-01; просмотров: 931;











