Скорость химических реакций.
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени (вступившего в реакцию или образовавшегося в результате реакции) в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
В химической кинетике различают среднюю и истинную (мгновенную) скорость.
Средняя скорость.
Если при неизменных объеме и температуре концентрация одного из реагирующих веществ изменилась от С1 до С2 за промежуток времени от τ1 до τ2, то в соответствии с определением средняя скорость прямой реакции за данный промежуток времени равна:
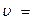 ±
± 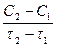 =
= 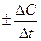 .
.
Знак «–» в правой части уравнения появляется, т. к. по мере протекания реакции концентрация реагентов убывает, следовательно, С2 – С1 < 0, а скорость реакции – всегда положительная.
Истинная скорость реакции определяется пределом, к которому стремится отношение 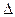 С/
С/ 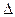 t при
t при 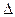 τ®0, т. е. производной концентрации по времени:
τ®0, т. е. производной концентрации по времени:
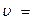
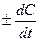 .
.
Обычно для реакций, протекающих в газах или растворах, концентрации реагентов выражают в моль/л, а скорость реакции — в моль/(л·с).
Дата добавления: 2020-08-31; просмотров: 516;











