Тема 4. Энергетика химических процессов
4.1 Энергетические эффекты химических реакций.
Системой в химии принято называть вещество или совокупность веществ, находящихся во взаимодействии с окружающими их телами. Последние поэтому называются окружающей средой.
Химические реакции сопровождаются выделением или поглощением энергии. Изучением тепловых эффектов реакций занимается термохимия. Термохимия составляет один из разделов химической термодинамики, изучающей переходы энергии из одной формы в другие и от одной совокупности тел к другим, а также возможность, направление и глубину осуществления химических и фазовых процессов в данных условиях.
Каждое отдельное вещество или их совокупность представляет собой термодинамическую систему. Если термодинамическая система не обменивается с окружающей средой ни веществом, ни энергией, ее называют изолированной. Такая идеализированная система используется как физическая абстракция при рассмотрении процессов, исключающих влияние внешней среды. Система, обменивающаяся с окружающей средой только энергией, называется закрытой. Если же возможен энергетический и материальный обмен – система открытая. В термохимии тепловой эффект реакции обозначается Q и выражается в кДж.
Состояние системы определяется термодинамическими параметрами состояния – температурой, давлением, концентрацией, объемом и т. д. Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G. Из изменение в ходе химических реакций характеризуют ее энергетику системы. Перечисленные свойства системы зависят от температуры, давления, концентрации, поэтому они называются функциями состояния, не зависят от пути процесса и определяются только конечным и начальным состояниями системы.
Внутренняя энергия системы U складывается из энергии движения и взаимодействия молекул, энергии связи в молекулах, энергии движения и взаимодействия электронов и ядер и т. п.
Абсолютная величина внутренней энергии не может быть определена, но ее изменение при переходе системы из начального состояния в конечное в результате осуществления химического процесса поддается расчету. Если система получает некоторое количество тепла при постоянном давлении Qp, последнее расходуется на изменение внутренней энергии системы ΔU и совершение работы A = PΔV против внешних сил:
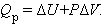
Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
В химии чаще всего рассматривают именно изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
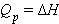
ΔH = ΔU + PΔV
Энтальпия системы, однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P.
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1 (или кДж/моль).
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное. Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так:
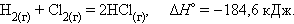
Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами: ΔН0298 или: ΔН0обр .
Стандартная энтальпия образования– тепловой эффект реакции (количество теплоты, которое выделяется или поглощается) образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Значения стандартных энтальпий образования веществ определяются экспериментально и заносятся в справочники.
Энтальпия образования простых веществ принята равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K.
Пользуясь табличными значениями, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.):
Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое.
Анализ закона Гесса позволяет сформулировать следующие следствия:
1. Энтальпия (теплота) химической реакции (ΔH0х.р.) равна разности сумм энтальпий (теплот) образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
ΔH0х.р. = Σ ΔН0298 кон – Σ ΔН0298.нач
2. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
ΔHобр = –ΔHразл
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
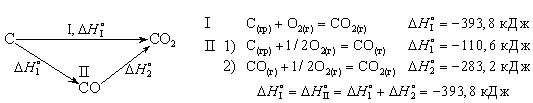
Рассмотрим это на примере расчета теплового эффекта (энтальпии) реакции:
NH3 + HCl → NH4Cl
Энтальпию (ΔHх.р. ) будем рассчитывать на основании следствия из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
ΔH0х.р. = Σ ΔН0298 кон – Σ ΔН0298.нач
В нашем случае DH0х.р.= DH0298 (NH4Cl) – DH0298 (HCl) – DH0298 (NH3)
Используя значения стандартных энтальпий образований из таблиц справочных изданий, найдем тепловой эффект реакции:
DH0х.р.= –315,39 – (–92,31) – (–46,19) = –176,89 кДж.
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими.
В данной задаче термохимическое уравнение реакции будет иметь вид:
NH3 (г) + HCl (г) → NH4Cl (г) DH0х.р.= –176,89 кДж
Дата добавления: 2020-08-31; просмотров: 521;











