Основные типы и характеристики химического взаимодействия.
1. Ковалентная связь – это двухцентровая двухэлектронная связь, образующаяся за счет перекрывания электронных облаков, несущих неспаренные электроны с антипараллельными спинами. Как правило, образуется между атомами одного химического элемента.
Количественно она характеризуется валентностью. Валентность элемента – это его способность образовывать определенное число химических связей за счет свободных электронов, находящихся атомной валентной зоне.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. Связь между атомами может осуществляться не только одной, но и двумя и даже тремя поделенными парами. Такие связи называются двойными и тройными - кратными связями.
1.1. Ковалентная неполярная связь. Связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной. Она возникает между атомами с практически равной электроотрицательностью (0,4 > ΔЭО > 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов у гомоядерных молекул. Например, Н2, О2, N2, Cl2 и т. д. Дипольный момент таких связей равен нулю. Связь СН в предельных углеводородах (например, в СН4) считается практически неполярной, т.к. Δ ЭО = 2,5(С) – 2,1(Н) = 0,4.
1.2. Ковалентная полярная связь. Если молекула образована двумя разными атомами, то зона перекрывания электронных облаков (орбиталей) смещается в сторону одного из атомов, и такая связь называется полярной. При такой связи вероятность нахождения электронов возле ядра одного из атомов выше. Например, НCl, H2S, PH3.
Полярная (несимметричная) ковалентная связь - связь между атомами с различной электроотрицательностью (2 > ΔЭО > 0,4) и несимметричным распределением общей электронной пары. Как правило, она образуется между двумя неметаллами.
Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда d- (дельта минус), а на менее электроотрицательном атоме - частичного положительного заряда d+ (дельта плюс)
Cd+- Cld-, Cd+- Od-, Cd+- Nd-, Od-- Hd+, Cd-- Mgd+.
Направление смещения электронов обозначается также стрелкой:
C®Cl, C®О, C®N, ОН, CMg.
Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения. Поэтому, чем полярнее связь, тем она прочнее.
Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. Третьим свойством ковалентной связи является ее направленность.
2. Ионная связь. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая «октетная» оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому, как правило, ионная связь образуется между металлом и неметаллом.
Рассмотрим в качестве примера реакцию между атомами натрия (3s1) и фтора (2s23s5). Разница электроотрицательности в соединении NaF
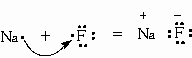
DЭО = 4,0 – 0,93 = 3,07
Натрий, отдав фтору свой 3s1-электрон, становится ионом Na+ и остается с заполненной 2s22p6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает фтор, приняв один электрон, отданный натрием. В результате возникают силы электростатического притяжения между противоположно заряженными ионами.
Ионная связь – крайний случай полярной ковалентной связи, основанная на электростатическом притяжении ионов. Такая связь возникает при большой разнице электроотрицательностей связываемых атомов (DЭО > 2), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщенности. В силу этого иoннaя связь не имеет пространственной направленности и насыщаемости, так как каждый ион связан с определенным числом противоионов (координационное число иона). Поэтому ионно-связанные соединения не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения, они высокополярны, часто солеобразны, в водных растворах электропроводны. Например, MgS, NaCl, А2O3. Соединений с чисто ионными связями практически не существует, поскольку всегда остается некоторая доля ковалентности в силу того, что полного перехода одного электрона к другому атому не наблюдается; в самых «ионных» веществах доля ионности связи не превышает 90 %. Например, в NaF поляризация связи составляет около 80 %.
В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов.
Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления, которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении.
Степень окисления – это условный заряд, который приобретает атом в результате перераспределения электронной плотности. Количественно она характеризуется числом смещенных электронов от менее электроотрицательного элемента к более электроотрицательному. Положительно заряженный ион образуется из того элемента, который отдал свои электроны, а отрицательный ион - из элемента, который эти электроны принял.
Элемент, находящийся в высшей степени окисления (максимально положительной), уже отдал все свои валентные электроны, находящиеся в АВЗ. А поскольку их количество определяется номером группы, в которой стоит элемент, то высшая степень окисления для большинства элементов и будет равна номеру группы. Что касается низшей степени окисления (максимально отрицательной), то она появляется при формировании восьмиэлектронной оболочки, то есть в том случае, когда АВЗ заполняется полностью. Для неметаллов она рассчитывается по формуле № группы – 8. Для металлов равна нулю, поскольку они электроны принимать не могут.
Например, АВЗ серы имеет вид: 3s23р4. Если атом отдаст все электроны (шесть), то приобретет высшую степень окисления +6, равную номеру группы VI, если примет два, необходимые для завершения устойчивой оболочки, то приобретет низшую степень окисления –2, равную № группы – 8 = 6 – 8= –2.
3. Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло– и электропроводность. Эти особенности объясняются существованием в металлах особого вида взаимодействия – металлической связи.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов, которые достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы, локализованные в определенных положениях кристаллической решетки, и большое количество делокализованных (свободных) электронов, сравнительно свободно перемещающихся в поле положительных центров и осуществляющих связь между всеми атомами металла за счет электростатического притяжения.
В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Силы связи в металлах не локализованы и не направлены, а свободные электроны, образующие «электронный газ», обусловливают высокую тепло- и электропроводность. Поэтому в этом случае невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении
Дата добавления: 2020-08-31; просмотров: 624;











