Донорно-акцепторная связь. Взаимодействие молекул. Агрегация однородных и разнородных молекул. Водородная связь. Силы межмолекулярного взаимодействия.
Донорно-акцепторная связь.Помимо механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый донорно-акцепторный механизм. Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей (неподеленной) электронной пары донора (поставщика электронов) в общее пользование донора и акцептора(поставщика свободной атомной орбитали).

 D + A → D A
D + A → D A
После образования она ничем не отличается от ковалентной. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (звездочками обозначены электроны внешнего уровня атома азота):
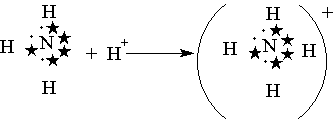
Электронная формула АВЗ атома азота 2s22р3, то есть он имеет три неспаренных электрона, которые вступают в ковалентную связь с тремя атомами водорода (1s1), каждый из которых имеет один валентный электрон. При этом образуется молекула аммиака NH3, в которой сохраняется неподеленная электронная пара азота. Если к этой молекуле подойдет протон водорода (1s0), не имеющий электронов, то азот передаст свою пару электронов (донор) на эту атомную орбиталь водорода (акцептор), в результате чего образуется ион аммония. В нем каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н—N, образованные по различным механизмам, никаких различий в свойствах не имеют. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s– и 2р– электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали.
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н+ в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н2О и иона Н+ всегда образуется ион гидроксония Н3О+ Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H+.
Водородная связь. Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), который «стягивает» на себя общую электронную пару, испытывает недостаток электронов и приобретает эффективный положительный заряд. Поэтому он способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома (который приобретает эффективный отрицательный заряд) этой же (внутримолекулярная связь) или другой молекулы (межмолекулярная связь). В результате возникает водородная связь, которая графически обозначается точками:
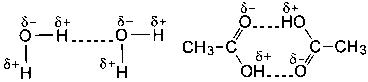
Эта связь значительно слабее других химических связей (энергия ее образования 10–40 кДж/моль) и в основном имеет частично электростатический, частично донорно-акцепторный характер.
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С. Типичные случаи ассоциации наблюдаются для спиртов и органических кислот.
Дата добавления: 2020-08-31; просмотров: 704;











