Фазовые переходы и равновесие. Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия.
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении. Например, если смешать пары йода с водородом при температуре 200°С, то произойдет реакция:
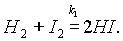
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на йод и водород:
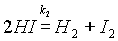 .
.
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода.
Обратимаяхимическая реакция – это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях, При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:
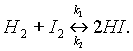
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Химическое равновесие – состояние системы, в котором скорость прямой реакции (υ1) равна скорости обратной реакции (υ2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
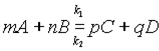 .
.
Согласно закону действующих масс, скорости прямой реакции u1 и обратной u2 соответственно запишутся следующим образом:
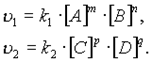
В равновесии скорости прямой и обратной реакций равны:
k1[A]m·[B]n = k2[C]p·[D]q.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (k1) и обратной (k2) реакций. Преобразуем эту формулу и получим:
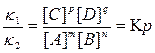 .
.
Константа равновесия (Кр или К) зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции, т. е. численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик (равновесие смещено в сторону прямой реакции ), так как при этом

Понятно, что при К << 1 выход реакции мал (.равновесие смещено в сторону обратной реакции ).
Дата добавления: 2020-08-31; просмотров: 442;











