Ионно-молекулярные равновесия
Реакции в растворах электролитов протекают между ионами растворённых веществ. Рассмотрим реакции двойного обмена. Любой электролит в результате электролитической диссоциации образует анионы и катионы, поэтому вне зависимости от того, имеются или не имеются ионы в веществе, условно электролиты можно представить состоящими из анионов и катионов. В реакциях двойного обмена происходит обмен ионами между взаимодействующими веществами (рис. 3.7)

Рис. 3.7 – Реакции двойного обмена
Решить вопрос о возможности протекания практически необратимых реакций двойного обмена и понять их сущность позволяют ионно-молекулярные реакции.
Правила составления уравнений ионно-молекулярных реакций
1. Составляется молекулярное уравнение реакции. Формулы веществ записываются в соответствии с правилом валентности. Рассчитываются (если необходимо) коэффициенты в соответствии с законом сохранения массы веществ.
2. Составляется полное ионно-молекулярное уравнение. В молекулярной форме следует записывать малорастворимые и газообразные вещества, а также слабые электролиты (табл. 3.5, 3.6).
Таблица 3.6
Растворимость солей кислот и оснований в воде
| Катион | H+ | K+, Na+ | NH4+ | Mg2+ | Ca2+ | Cu2+ | Zn2+ | Mn2+ | Fe2+ | Fe3+ | AI3+ | Ва2+ |
| Анион | ||||||||||||
| OH- | Р | Р | Н | М | Н | Н | Н | Н | Н | Н | Р | |
| CI- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| S2- | Р | Р | Р | ─ | ─ | Н | Н | Н | Н | Н | ─ | ─ |
| SO32- | Р | Р | Р | М | М | ─ | М | Н | М | ─ | ─ | Н |
| SO42- | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Н |
| CO32- | Р | Р | Р | М | Н | Н | Н | ─ | Н | ─ | ─ | Н |
| HCO3– | Р | Р | Р | Р | Р | ─ | ─ | ─ | Р | Р | Р | Р |
| SiO32- | Н | Р | Р | Н | Н | Н | Н | ─ | Н | Н | Н | Н |
| РО43─ | Р | Р | ─ | Н | Н | Н | Н | Н | Н | Н | Н | Н |
Примечание. Р ─ растворимое вещество, М ─ малорастворимое, Н─ нерастворимое, «─» ─ разлагается водой
Все эти вещества или не образуют в растворах ионов, или образуют их очень мало. В видеионов записывают сильные кислоты и основания, а также растворимые соли. Эти электролиты существуют в растворе в виде ионов, но не молекул (рис. 3.6).
3. Составляется сокращённое ионно-молекулярное уравнение.Ионы, которые в ходе реакции не изменяются, сокращаются. Полученное уравнение показывает суть реакции.
 |
В качестве примера решим вопрос о том, в каком случае произойдет химическое взаимодействие: если к раствору хлорида кальция добавить раствор нитрата натрия или сульфата натрия? Ответ подтвердите, написав ионно-молекулярные реакции.
Запишем молекулярные уравнения предполагаемых реакций, указав растворимость всех участников реакции ( Р – растворимое,Н – нерастворимое ). Все растворимые соли являются сильными электролитами.
CaCl2 + 2NaNO3 → Ca(NO3)2 + 2NaCl; CaCl2 + Na2SO4 → CaSO4↓ + 2NaCl.
Р Р Р Р Р Р Н Р
В соответствии с правилами написания ионно-молекулярных уравнений сильные, растворимые электролиты запишем в виде ионов, аслабые или нерастворимые – в видемолекул.
Ca2+ + 2Cl‾ + 2Na+ + 2NO3‾ → Ca2+ + 2NO3‾ + 2Na+ + 2Cl‾;
Ca2+ + 2Cl‾ + 2Na+ + SO4 2‾ → CaSO4 ↓ + 2Na+ + 2Cl‾.
В первом случае все ионы сокращаются, а во втором – сокращенное ионно-молекулярное уравнение имеет вид: Ca2+ + SO42‾ → CaSO4 ↓, т.е. в данном случае имеет место химическое взаимодействие с образованием малорастворимого вещества. Данная реакция является практически необратимой, т.к. в обратном направлении, т.е. в сторону растворения осадка, она протекает в очень незначительной степени (рис. 3.8).

Рис. 3.8 – Практически необратимая реакция двойного обмена с образованием осадка
Рассмотрим реакции, приводящие к образованию слабого электролита и газа (рис. 3.9).
NH4Cl + KOH → NH4OH + KCl,
NH4+ + Cl¯ + K+ + OH¯ → NH4OH + K+ + Cl¯,
NH4+ + OH¯ → NH4OH.
Na2CO3 + 2 HCl → 2 NaCl + H2CO3 (H2O + CO2↑),
2 Na+ + CO32¯ + 2 H+ + 2 Cl → 2 Na+ + 2 Cl¯ + H2O + CO2↑,
2 H+ + CO32¯ → H2O + CO2↑.

Рис. 3.9 – Практически необратимые реакции двойного обмена
с образованием слабого электролита и газа

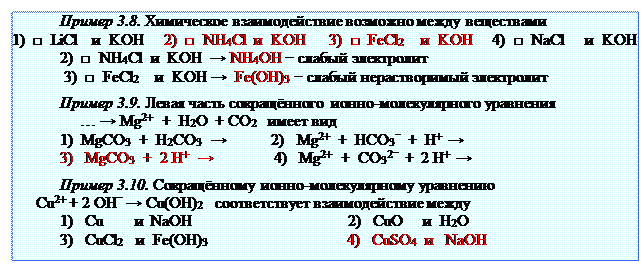
Если малорастворимые или малодиссоциирующие вещества есть и среди исходных веществ и среди продуктов реакции, то ионно-молекулярное равновесие смещается в сторону менее диссоциирующего или менее растворимого электролита.
СН3СООН + NaOH ↔ CH3COONa + H2O,
СН3СООН + Na + + OH¯ ↔ СН3СОО¯ +Na+ + H2O,
СН3СООН + OH¯ ↔ СН3СОО¯ + H2O.
слабая кислота слабый электролит
Константа диссоциации уксусной кислоты равна около 10–5 , а воды около 10–16 ,т.е. вода является более слабым электролитом и равновесие смещено в сторону образования продуктов реакции.
Дата добавления: 2020-07-18; просмотров: 611;











