Равновесия в растворах солей. Гидролиз
При растворении соли в воде происходит её электролитическая диссоциация на анионы и катионы, которые могут взаимодействовать с водой. Гидролизу подвергаются ионы слабых электролитов. Если катион соли является остатком слабого основания, то в результате взаимодействия с водой образуется слабое основание (соль гидролизуется по катиону). Если анион соли – остаток слабой кислоты, то в результате гидролиза образуется слабая кислота (соль гидролизуется по аниону).
Хлорид аммония NH4Cl образован слабым основанием NH4OH и сильной кислотой HCl. При растворении соль вступает в обменное взаимодействие с водой. Напишем молекулярное и ионно-молекулярные уравнения гидролиза данной соли
NH4Cl + HOH ↔ NH4OH + HCl;
слабый электролит слабый электролит
NH4+ + Cl‾+ HOH ↔ NH4OH + H+ + Cl‾;
NH4+ + HOH ↔ NH4OH + H+.
В данном случае устанавливается ионно-молекулярное равновесие, так как слабый электролит (Н2О) является одним из исходных веществ и слабое основание NH4OH – один из продуктов реакции.
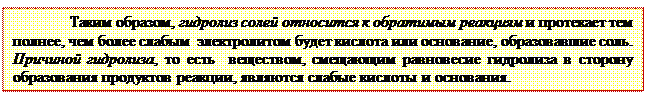
В результате взаимодействия с водой хлорида аммония в растворе накапливаются свободные ионы Н+ и реакция среды становится кислой, т.к. СН+ > СОН ˉ.Раствор данной соли окрасит лакмус и универсальный индикатор в красный цвет.NH4Cl гидролизуется по катиону ─ остатку слабого основания.
Нитрит натрия NaNO2 образован слабой кислотой HNO2 и сильным основанием NaOH. Уравнения гидролиза нитрита натрия выглядят так:
NaNO2 + HOH ↔ NaOH + HNO2;
слабый электролит слабый электролит
Na+ + NO2‾ + HOH ↔ Na+ + OH‾ + HNO2;
NO2‾ + HOH ↔ OH‾ + HNO2.
Реакция среды в растворе нитрита натрия щелочная вследствие накопления свободных ионов ОН ˉ, так как СН+ < СОНˉ. Причиной гидролиза является образование слабой кислоты – HNO2 , т.о. NaNO2 гидролизуется по аниону, раствор нитрита натрия фенолфталеин окрасит в малиновый цвет, лакмус, метилоранж и универсальный индикатор − в красный цвет.
Нитрит аммония образован слабым основанием NH4OH и слабой кислотой HNO2. При взаимодействии с водой образуются данные слабые электролиты:
NH4 NO2 + НОН ↔ NH4OH + HNO2;
слабый электролит слабый электролит
NH4+ + NO2‾ + НОН ↔ NH4OH + HNO2.
В данном случае рН среды меняется незначительно, т.к. СН+ ≈ СОН–.
NH4 NO2 гидролизуется как по катиону, так и по аниону.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, и pH среды не меняется, например:
NaCl + HOH ↔ NaOH + HCl;
слабый электролит
Na+ + Cl‾ + HOH ↔ Na+ + OH– + H+ + Cl‾;
HOH ↔ H+ + OH‾ .


Дата добавления: 2020-07-18; просмотров: 617;











