РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Экспериментально было показано, что водные растворы кислот, щелочей и солей, названные впоследствии электролитами, показывают отклонения от законов Рауля и Вант-Гоффа, которые можно учесть, если ввести поправочный изотонический коэффициент i(табл.3.3).
Впоследствии реальные растворы стали описывать в соответствии с закономерностями, присущими идеальным растворам, введя понятие активности(а):
а = γ · с,
где γ ─ коэффициент активности, формально учитывающий все виды взаимодействия час-
тиц в реальном растворе;
с ─ концентрация раствора.
Осмотическое давление, температура замерзания и кипения растворов пропорциональны концентрации раствора, т.е. числу растворённых частиц. Изотонический коэффициент всегда больше единицы, что можно объяснить разложением растворённых молекул на более мелкие частицы.
Таблица 3.3
Формулы для расчёта осмотического давления и изменения температур
кипения и замерзания водных растворов
| Фактор | Формулы для расчёта | |
| неэлектролит | электролит | |
| Осмотическое давление | π = cм R T | π = i · cм R T |
| Повышение температуры кипения | Δ Т кипения = Е Н2О · с m | Δ Т кипения = i · Е Н2О · с m |
| Понижение температуры замерзания | Δ Т амерзания = К Н2О · с m | Δ Т замерзания = i · К Н2О· с m |
В 1887 году шведский учёный С. Аррениус выдвинул гипотезу о том, что соли, кислоты и основания в воде диссоциируют на ионы ─ подвергаются электролитической диссоциации, механизм которой можно рассмотреть на примере диссоциации хлорида калия (рис. 3.6).
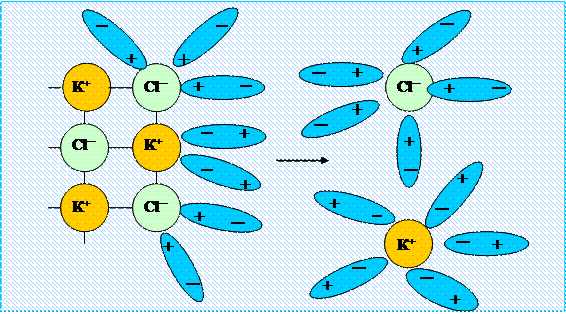
Рис. 3.6 ─ Схема процесса диссоциации хлорида калия
При растворении в воде полярные молекулы ориентируются противоположно заряженными концами к ионам калия и хлора, которые гидратиратируются и отщепляются от кристалла соли. Электролитическая диссоциация (разложение вещества на ионы) записывается без участия молекул воды:
KCl → K+ + Cl¯.
Положительно заряженные ионы называются катионами, отрицательно заряженные ─ анионами. Электролитическая диссоциация веществ с ковалентной полярной связью имеет предварительную стадию ионизации, когда под влиянием полярных молекул растворителя происходит увеличение полярности химической связи.


Для сильных электролитов (табл. 3.4) степень диссоциации равна единице, для слабых она значительно меньше единицы. Отсюда следует, что в растворах сильных электролитов вещество находится в виде ионов, в растворах слабых – в виде молекул и небольшого числа ионов, в неэлектролитах – в виде молекул.
Таблица 3.4
Сильные и слабые электролиты
| Электролиты | Сильные | Слабые |
| Кислоты | HNO3, HCl, HBr,H2SO4 и другие | HNO2, H2S, H2SO3, H2CO3, H2SiO3, H3PO4, HF и другие |
| Основания | KOH, NaOH, Ba(OH)2 и другие | NH4OH, нерастворимые основания |
| Соли | практически все соли | ─ |
Примечание: к слабым электролитам относится также вода.
Электролитическая диссоциация сопровождается увеличением числа частиц в растворе и поглощением теплоты, поэтому, в соответствии с принципом Ле Шателье, степень диссоциации уменьшается с ростом концентрации раствора и охлаждении.
В концентрированных растворах неэлектролитов и особенно электролитов число растворённых частиц велико и взаимодействия их как между собой, так и с молекулами растворителя становятся настолько значительными, что реальная (эффективная) их концентрация не совпадает с аналитической. В таких растворах вместо концентрации «с» пользуются активностью «а».
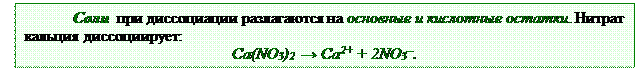
Процесс диссоциации сильных электролитов происходит сразу в одну ступень. С точки зрения теории электролитической диссоциации:
 |



Диссоциация слабых электролитов протекает в малой степени, поэтому в растворе присутствуют недиссоциированные молекулы и небольшое число ионов. Диссоциацию слабых электролитов записывают как обратимый процесс и характеризуют константой диссоциации (табл. 3.5).
Электролитическая диссоциация слабой азотистой кислоты и слабого гидроксида аммония протекают в одну ступень обратимо и характеризуются соответствующими константами диссоциации (табл. 3.5).
Азотистая кислота: HNO2 <══> Н+ + NO2¯ ; 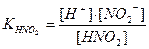 .
.
Гидроксид аммония: NH4OH <══> NH4+ + OH¯ ; 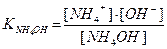
Таблица 3.5
Константы диссоциации кислот и оснований в водных растворах
| Вещество | Константа диссоциации | |||
| КI | КII | КIII | ||
| HF | 6,6 ∙ 10─4 | ─ | ─ | |
| HNO2 | 4,0 ∙ 10─4 | ─ | ─ | |
| H2S | 1,1 ∙ 10─7 | 1,0 ∙ 10─14 | ─ | |
| H2SO3 | 1,6 ∙ 10─2 | 6,3 ∙ 10─8 | ─ | |
| H2CO3 | 4,5 ∙ 10─7 | 4,8 ∙ 10─11 | ─ | |
| H2SiO3 | 1,3 ∙ 10─10 | 2,0 ∙ 10─12 | ─ | |
| H3PO4 | 7,5 ∙ 10─3 | 6,3 ∙ 10─8 | 1,3 ∙ 10─12 | |
| NH4OH | 1,8 ∙ 10─5 | ─ | ─ | |
| Cu(OH)2 | ─ | 3,4 ∙ 10─7 | ─ | |
| Fe(OH)2 | ─ | 1,3 ∙ 10─4 | ─ | |
| Fe(OH)3 | ─ | 1,8 ∙ 10─11 | 1,4 × 10─12 | |
| Zn(OH)2 | 4,4 ∙ 10─5 | 1,5 ∙ 10─9 | ─ | |
| Mg(OH)2 | ─ | 2,5 ∙ 10─3 | ─ | |
| Pb(OH)2 | 9,6 ∙ 10─4 | 3,0 ∙ 10─8 | ─ | |
Константа электролитической диссоциации характеризует равновесие диссоциации только слабых электролитов. Чем меньше величина константы диссоциации, тем более слабым является электролит.
Двухосновные слабые кислоты и двухкислотные слабые основания диссоциируют в две ступени и имеют две константы диссоциации. Ступеней и констант диссоциации столько, какова валентность кислотного или основного многовалентного остатка.
Электролитическая диссоциация слабых электролитов, как процесс обратимый, подчиняясь принципу Ле Шателье, увеличивается с разбавлением раствора, т.к. происходит уменьшение концентрации ионов в растворе. Кроме того, электролитическая диссоциация происходит с поглощением теплоты, а поэтому возрастает при нагревании. Электролитическая диссоциация слабой угольной кислоты и слабого гидроксида железа (II) протекают в две ступени обратимо и характеризуются соответствующими константами диссоциации.
В растворах сильных электролитов концентрация ионов велика и проявляется взаимодействие ионов друг с другом, с полярными молекулами растворителя, на свойства раствора более сильное влияние оказывает процесс образования гидратов и т.д. Вся совокупность взаимодействий между частицами в растворах учитывается введением вместо концентрации активности.
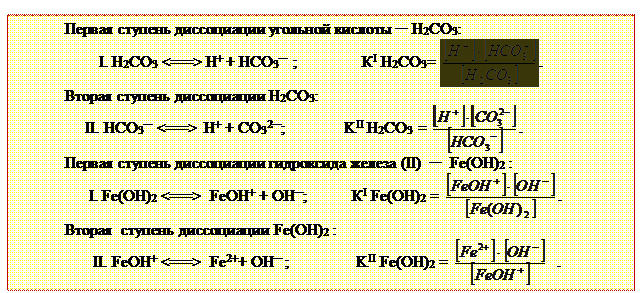
Дата добавления: 2020-07-18; просмотров: 615;











