Жёсткость природных вод
Вода является важнейшим универсальным растворителем. Состав природных вод определяется многими факторами, но, прежде всего, составом горных пород и почв. Воды, фильтрующиеся через известняковые горные породы, содержат значительные количества растворимых солей магния и кальция, т.е. являются жёсткими.
Основной составляющей известняков является карбонат кальция, доломитов ─ двойная соль MgCO3· CaCO3. Природные воды растворяют из воздуха углекислый газ, в результате чего образуется угольная кислота:
СО2 + Н2О = Н2СО3.
При избыточном сверх равновесного количестве углекислого газа средняя нерастворимая соль (CaCO3) переходит в кислую растворимую (Са(НСО3)2):
CaCO3 + СО2 + Н2О = Са(НСО3)2 (рис. 3.5).
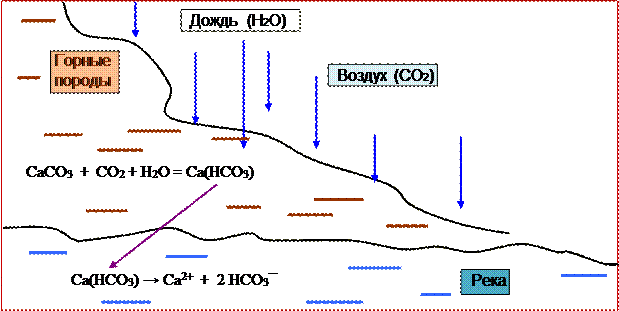
Рис. 3.5 ─ Схема появления солей жёсткости в природных водах
Различают жёсткость временную, постоянную и общую. Временная жёсткость обусловлена присутствием в воде гидрокарбонатов, постоянная – всеми остальными растворимыми солями кальция и магния, остающимися в воде после её кипячения. Общая жёсткость равна сумме временной и постоянной.
Жёсткость воды измеряется числом ммоль эквивалентов ионов Са2+ и Mg2+, содержащихся в одном литре воды, поэтому единицы её измерения – ммоль/л. Мягкие воды имеют общую жёсткость до 3 ммоль/л, воды средней жёсткости – до 6 ммоль/л, жёсткие – до 10 ммоль/л и очень жёсткие – более 10 ммоль/л. Использование жёстких вод недопустимо во многих технологических процессах, в частности, воды с повышенным содержанием ионов кальция и магния вызывают неконтролируемые процессы при изготовлении бетона, жёсткость питьевой воды не должна превышать 7 ммоль/л.
Сущность умягчения воды состоит в удалении из неё тем или иным способом солей, обусловливающих жёсткость. Cоли временной жёсткости устраняют нагреванием воды до 95 0С, добавлением извести Са(ОН)2, при этом в осадок выпадают малорастворимые соединения СаСО3 или Mg(OH)2:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 ↓ + 2Н2О,
или: Mg(НСО3)2 + Са(ОН)2 → Mg(OH)2 ↓ + СаСО3 + H2O + CO2.
Соли постоянной жёсткости осаждают реагентами – содой (Na2CO3), известью, фосфатом натрия, а также другими методами в зависимости от потребностей производства.
Дата добавления: 2020-07-18; просмотров: 568;











