Реакция среды характеризуется через водородный показатель
pH = ─ lg [Н+].
При решении задач будем пользоваться формулойpН = – lg сH+ . В более точных расчётах следует пользоваться активностью ─ pН = – lg аH+ .
Если подставить значения концентраций ионов водорода сH+, полученные в вышеприведённом примере,в формулу для вычисления рН, то получим:
в нейтральной среде: рН = −lg 10–7=7;
в кислой среде: рН = −lg 10–6=6;
в щелочной среде: рН = −lg 10–8= 8.
Следовательно:

Данные сведения находят отражение в шкале рН (рис. 3.10).

Рис. 3.10 – Шкала рН
Пример 3.11.Раствор гидроксида аммония с молярной концентрацией 0,01 моль/л (0,01 М NH4OH) имеет рН = 10. Вычислить степень диссоциации основания.
Гидроксид аммония диссоциирует по уравнению: NH4OH ↔ NH4+ + OH ‾, поэтому число продиссоциировавших молекул основания равно числу ионов OH ˉ, которые образовались при диссоциации:
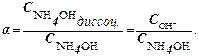
Из определения рН = – lg CН+ следует, что СН+ = 10–рН, в нашем случае СН+ = 10-10 моль/л.
Зная ионное произведение воды [H+]×[OH─]= 10-14 , рассчитаем СОН¯ : 
С ОН– = 10-14 : 10-10 = 10 – 4. Тогда 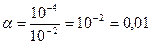 .
.
Пример 3.12.Раствор уксусной кислоты с молярной концентрацией 0,1 моль/л (0,1 М СН3СООН) имеет рН = 2. Вычислить степень диссоциации кислоты.
Уксусная кислота диссоциирует по уравнению
СН3СООН ↔ СН3СОО‾ + Н+,
поэтому число продиссоциировавших молекул кислоты равно числу ионов Н+, которые образовались при диссоциации и степень диссоциации уксусной кислоты:
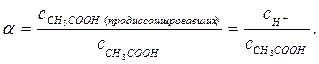
Из определения рН = – lg CН+ следует, что СН+ = 10–рН, тогда в нашем случае:
СН+ = 10–2 = 0,01. Тогда α = (0,01) : (0,1) = 0,1.
Пример 3.13.Раствор гидроксида бария имеет рН = 12, его концентрация в растворе при 100 % -ной диссоциации (α = 1) равна _____ моль/л
1) 0,05 2) 0,001 3) 0,005 4) 0,01
Из условия задачи находим концентрацию ионов ОНˉ:
рН = 12, => СН+ = 10ˉ12 и С ОН– = 10-14 : 10-12 = 10 – 2 = 0,01 (моль/л).
При электролитической диссоциации 1 моль гидроксида бария образуется 2 моль ионов ОНˉ: Ва(ОН)2 → Ва2+ + 2ОН¯, следовательно концентрация раствора в два раза меньше, т.е. составляет 0,005 моль/л.
Наиболее простым способом оценки рН среды является использование кислотно-основных индикаторов. Окраска индикаторов (рис. 3.11) зависит от строения молекул и определяется наличием особых групп – хромофоров.

Рис. 3.11 – Окраска некоторых индикаторов в различных средах
Дата добавления: 2020-07-18; просмотров: 673;











