Влияние температуры на константу равновесия
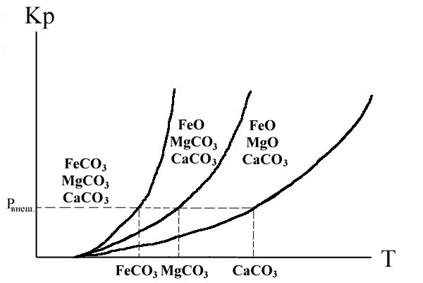
Примеры:
| 2МеO(тв.) Û 2Me(тв.) + O2(г) | 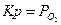 - парциальное давление пара - парциальное давление пара
|
| 2МgO(тв.) Û 2Mg(г) + S2(г) | 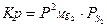 - парциальные давления паров - парциальные давления паров
|
| C + O2 Û CO2 | 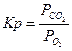
|
| CO2 + C Û CO | 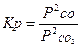
|
| C + 0,5O2 Û CO | 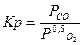
|
| NH4HS(тв.) Û NH3(г) + H2S(г) | 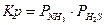
|
Пример расчета равновесия
Задача: вычислить выход NH3 при синтезе N2 и H2.
N2(г) + 3H2(г) Û NH3(г)
Порядок расчета:
1. Задать температуру и при ней определить Kp
Температура 500К, 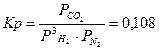 , где давление выражено в атмосферах
, где давление выражено в атмосферах
2. Составить таблицу
| № пп | Вещества, участвующие в реакции | H2 | N2 | NH3 |
| Исходное число молей | ||||
| Прореагирует молей | 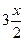
| 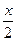
| - | |
| Равновесное число молей (n) | 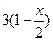
| 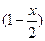
| x | |
| Сумма равновесных молей (Snравн.) | 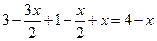
| |||
Равновесное парциальное давление
( 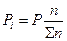 ) )
| 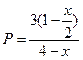
| 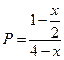
| 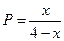
| |
| Равновесные концентрации | 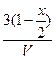
| 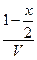
| 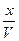
|
- Подставить равновесные парциальные давления из таблицы в закон действующих масс при 500К
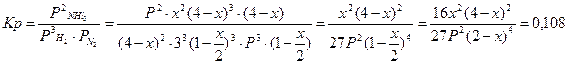
На величину x, кроме температуры, влияет и общее давление. Чем выше давление, тем больше величина x (по принципу Ле-Шателье). Чем выше давление, тем больше равновесие смещено в сторону образования NH3.
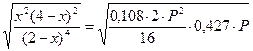 Þ x1 = 2,137; x2 = 1,863, но х должно быть меньше двух, т.е. х = 2,137 – 100%.
Þ x1 = 2,137; x2 = 1,863, но х должно быть меньше двух, т.е. х = 2,137 – 100%.
Дата добавления: 2021-09-07; просмотров: 546;











